已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC
2O
4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.右图是利用饱和草酸溶液与KClO
3粉末在60℃时反应制得ClO
2,ClO
2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
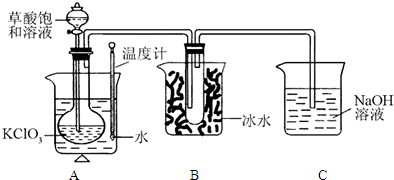
(1)该反应的反应原理为以下化学方程式,试配平:
KClO
3+
H
2C
2O
4=
KHCO
3+
ClO
2↑
(2)B装置的作用是
.
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO
2、NaClO
3等溶质,有同学说,C中还可能含有Na
2CO
3,试分析可能的原因
(4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl
2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO
3;
假设2:既存在CaCO
3,也存在CaC
2O
4;
假设3:
.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol?L
-1 H
2SO
4、0.1mol?L
-1 HCl、0.01mol?L
-1 KMnO
4、澄清石灰水.




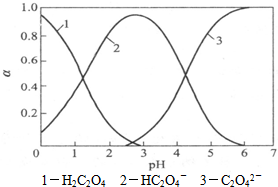 草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示: