
题目列表(包括答案和解析)
某同学用含硫酸亚铁等杂质的工业硫酸铜制取纯净的氧化铜以探究其性质。
(1)制备氧化铜
①将工业硫酸铜加适量水溶解、搅拌、过滤除去不溶性杂质。简述检验滤液中含有Fe2+的操作方法: 。
②向滤液中滴加H2O2溶液,稍加热,当Fe2+转化完全后,为将Fe3+全部转化为Fe(OH)3沉淀,而不会将Cu2+转化为沉淀,需慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5。加热煮沸后过滤,用稀硫酸酸化滤液至pH=1。再从溶液中分离出硫酸铜晶体。Fe2+转化为Fe3+的离子方程式是 。
③在测定所得硫酸铜晶体(CuSO4·xH2O)x值的实验中,所用的玻璃仪器名称为:酒精灯、
玻璃棒、 ,实验过程中称量操作至少进行 次。
④用得到的硫酸铜晶体制氧化铜。
(2)探究氧化铜的性质
在加热条件下,向下图所示装置中持续通入某纯净物X的蒸气,a处黑色物质变为红色,b处白色粉末变为蓝色,c处有无色液体产生。(设各步反应均进行完全)
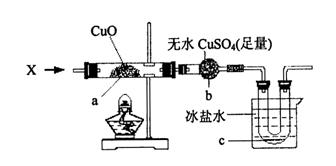
则X可能是 (填一个化学式即可),X与CuO反应的化学方程式是
。

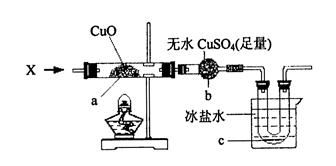
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 6.7 |
(10分)某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的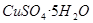 。
。
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加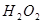 溶液,稍加热。
溶液,稍加热。
III.向II的溶液中加入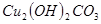 粉末至
粉末至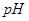 为
为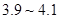 。
。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至 。
。
V. 加热浓缩、冷却结晶、过滤,得晶体。
已知部分阳离子生成氢氧化物的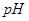 如下表:
如下表:
| 物质 | 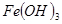 | 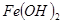 | 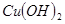 |
开始沉淀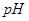 | 2.7 | 7.6 | 4.7 |
完全沉淀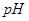 | 3.7 | 9.6 | 6.7 |
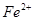 氧化为
氧化为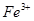 的目的是 。
的目的是 。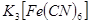 (铁氰化钾)验证II中
(铁氰化钾)验证II中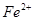 是否转化完全的现象是 。
是否转化完全的现象是 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com