
题目列表(包括答案和解析)
某同学对实验室中失去标签的石灰石样品进行纯度(样品中碳酸钙的质量分数)测定,取这种石灰石样品12.5 g,加入94.4 g一定质量分数的稀盐酸。充分反应后,共收集到4.4 g二氧化碳气体(石灰石中的杂质既不溶于水,也不与稀盐酸反应)。求:
(1)石灰石样品中碳酸钙的质量分数。
(2)反应后所得溶液中溶质的质量分数。
在实验室里,甲、乙两同学欲测定碳酸钙样品中碳酸钙的质量分数(杂质不与酸反应,且受热不分解),分别设计了甲、乙两个实验方案,请回答方案中的问题.
甲方案:①称取一定质量的碳酸钙样品;②用酒精灯加热样品,直到质量不再改变;③在干燥的器皿中将固体残余物冷却后称量;④计算.
问题(1):甲为什么要加热样品,直至质量不再改变?________
问题(2):甲为什么要将固体残余物放在干燥的器皿中冷却?________
乙方案:①称取碳酸钙样品12.5 g;②加入质量分数为10%的盐酸109.5 g,使碳酸钙完全反应;③向反应后的溶液中加入质量分数为8%的氢氧化钠溶液50 g,恰好中和过量盐酸;④计算.
问题(3):称量样品时,所需的仪器是________.
问题(4):写出碳酸钙与盐酸反应的化学方程式:________.
问题(5):乙方案中,样品中碳酸钙的质量分数是________.
综上所述,你认为甲、乙两方案中,切实可行的方案是________.不采用另一个方案的原因是:________.
在实验室里,甲、乙两同学欲测定碳酸钙样品中碳酸钙的质量分数(杂质不与酸反应,且受热不分解),分别设计了甲、乙两个实验方案,请回答方案中的问题.
甲方案:①称取一定质量的碳酸钙样品;②用酒精灯加热样品,直至质量不再改变;③在干燥的器皿中将固体残余物冷却后称量;④计算.
问题(1):甲为什么要加热样品,直至质量不再改变?________.
问题(2):甲为什么要将固体残余物放在干燥的器皿中冷却?________.
乙方案:①称取碳酸钙样品12.5 g;②加入质量分数为10%的盐酸109.5 g,使碳酸钙完全反应;③向反应后的溶液中,加入质量分数为8%的氢氧化钠溶液50 g,恰好中和过量盐酸;④计算.
问题(3):称量样品时,所需的仪器是________.
问题(4):写出碳酸钙与盐酸反应的化学方程式:________.
问题(5):乙方案中,样品中碳酸钙的质量分数是________.
综上所述,你认为甲、乙两方案中,切实可行的方案是________,不采用另一个方案的原因是:________.
在实验室里,甲、乙两同学欲测定碳酸钙样品中碳酸钙的质量分数
(杂质不与酸反应,且受热不分解),分别设计了甲、乙两个实验方案,请回答方案中的问题.甲方案:①称取一定质量的碳酸钙样品;②用酒精灯加热样品,直至质量不再改变
(反应的化学方程式为 );③在干燥的蒸发皿中将固体残留物冷却后称量;④计算.
);③在干燥的蒸发皿中将固体残留物冷却后称量;④计算.
问题
(1)甲为什么要加热样品,直至质量不再改变?问题
(2)甲为什么要将固体残留物放在干燥的蒸发皿中冷却?乙方案:①称取碳酸钙样品
12.5g;②加入质量分数为10%的盐酸73g,使碳酸钙恰好完全反应;③计算.问题
(3)称取样品时,所需的仪器有托盘天平.问题
(4)写出碳酸钙与盐酸反应的化学方程式: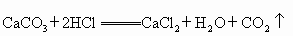
问题
(5)乙方案中,样品碳酸钙的质量分数是80%.综上所述,你认为甲、乙两方案中,切实可行的方案是
_______.不采用另一个方案的原因是__________.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com