
题目列表(包括答案和解析)
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
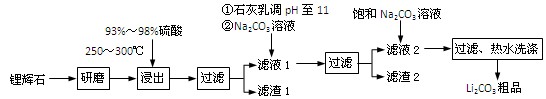
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
|
T/℃ |
20 |
40 |
60 |
80 |
|
|
1.33 |
1.17 |
1.01 |
0.85 |
|
|
34.2 |
32.8 |
31.9 |
30.7 |
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:

(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: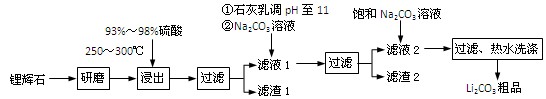
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

共12分) 下图中,A为芳香化合物,苯环上有两个邻位取代基:
请回答:
(1)、B所含的官能团的名称是 [来源:Zxxk.Com]
(2)、反应C→D的化学方程式是
反应类型是
(3)、A的结构简式是 、E的结构简式是
(4)、C在一定条件下可生成一种高分子化合物H,请写出C→H的化学方程式:
。
(5)、 mol G的溶液可跟 mo1CO2反应
mol G的溶液可跟 mo1CO2反应
(6)、B有多种同分异构体,写出属于酯类且能发生银镜反应的同分异构体的结构简式
。
共12分) 下图中,A为芳香化合物,苯环上有两个邻位取代基:

请回答:
(1)、B所含的官能团的名称是 [来源:Zxxk.Com]
(2)、反应C→D的化学方程式是
反应类型是
(3)、A的结构简式是 、E的结构简式是
(4)、C在一定条件下可生成一种高分子化合物H,请写出C→H的化学方程式:
。
(5)、 mol G的溶液可跟
mo1CO2反应
mol G的溶液可跟
mo1CO2反应
(6)、B有多种同分异构体,写出属于酯类且能发生银镜反应的同分异构体的结构简式
。
某化学小组采用类似制乙酸乙酯的装置(如图),以环已醇制备环已烯



已知:
| 密度 (g/cm3) | 溶点 (℃) | 沸点 (℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 能溶于水 |
(1)制备粗品
将12.5mL环已醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环已烯粗品中含有环已醇和少量酸性杂质等。加入饱和和食盐水,振荡、静置、分层,环已烯在 层(填上或下),分液后用 (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.NaCO3溶液
②再将环已烯按下图装置蒸馏,冷却水从 口进入。蒸馏时要加入生石灰,目的是 。
③收集产品时,控制的温度应在 左右,实验制得的环已烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品
b.环已醇实际用量多了
c.制备粗品时环乙醇随产品一起蒸出
(3)以下区分环已烯精品的粗品的方法,合理的是 。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com