
题目列表(包括答案和解析)
KIO3在酸性条件下是一种较强的氧化剂,在碱性介质中能被Cl2、次氯酸盐氧化为KIO4。KIO3在常温下稳定,加热至560℃开始分解。工业生产KIO3的流程如下:
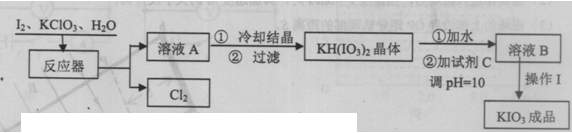
(1)写出反应器中生成KH(IO3)2的化学方程式:
6I2+11KClO3+3H2O= 。
当有1.2 mol电子转移的时候,生成KH(IO3)2的物质的量为 。
(2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
(3)调pH=10时,所加试剂C最好是 。
A.NaOH B.NH3·H2O C.KOH D.KCI
(4)从溶液B中得到碘酸钾固体,进行的操作I包括 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
KIO3在酸性条件下是一种较强的氧化剂,在碱性介质中能被Cl2、次氯酸盐氧化为KIO4。KIO3在常温下稳定,加热至560℃开始分解。工业生产KIO3的流程如下:
(1)写出反应器中生成KH(IO3)2的化学方程式:
6I2+11KClO3+3H2O= 。
当有1.2 mol电子转移的时候,生成KH(IO3)2的物质的量为 。
(2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
(3)调pH=10时,所加试剂C最好是 。
A.NaOH B.NH3·H2O C.KOH D.KCI
(4)从溶液B中得到碘酸钾固体,进行的操作I包括 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
KIO3在酸性条件下是一种较强的氧化剂,在碱性介质中能被Cl2、次氯酸盐氧化为KIO4。KIO3在常温下稳定,加热至560℃开始分解。工业生产KIO3的流程如下:
(1)写出反应器中生成KH(IO3)2的化学方程式:
6I2+11KClO3+3H2O= 。
当有1.2 mol电子转移的时候,生成KH(IO3)2的物质的量为 。
( 2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
(3)调pH=10时,所加试剂C最好是 。
A.NaOH B.NH3·H2O C.KOH D.KCI
(4)从溶液B中得到碘酸钾固体,进行的操作I包括 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生:①IO3-+5I-+6H+===3I2+3H2O ②I2+HSO3-+H2O===2I-+SO42-+3H+。当反应进行到15 min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是( )
A.在整个反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关
| A.在整个反应过程中,起催化作用的物质是KI |
| B.上述两个反应中,反应速率较快的是② |
| C.时钟反应的快慢由反应②决定 |
| D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com