
题目列表(包括答案和解析)

| NaOH |
| 水溶液△ |
| 自动脱水 |



 (X代表卤原子)
(X代表卤原子) +
+
| 浓硫酸 |
| △ |
 +H2O
+H2O +
+
| 浓硫酸 |
| △ |
 +H2O
+H2O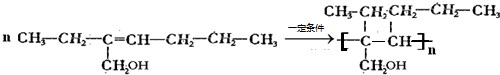
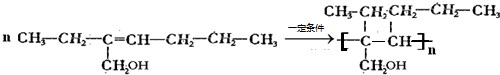


(16分) 已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
|
元素 |
结构或性质信息 |
|
X |
原子的L层上s电子数等于p电子数。 |
|
Y |
原子核外的L层有3个未成对电子。 |
|
Z |
在元素周期表的各元素中电负性仅小于氟。 |
|
Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
|
R |
核电荷数是Y与Q的核电荷数之和 |
|
E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2) X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的核外电子排布式为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心原子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6) Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为 。
硫化物通常有“废物”之称。硫化物据其溶解性可以分三类: ① 易溶于水的有 K2S 、Na2S 、(NH4)2S 等; ② 易溶于非氧化性强酸、不溶于水的有 FeS 、 ZnS ; ③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如 HgS 、 Ag2S 、 CuS 、 Cu2S 。其中,Ag2S、 CuS 、 Cu2S 能溶于硝酸发生氧化还原反应,而 HgS只能溶于王水(硝酸与盐酸的混合液)。氢硫酸溶液中存在下列平衡:
H2S ![]() H ++ HS-, HS-
H ++ HS-, HS- ![]() H + + S2-。
H + + S2-。
(1)K2S溶液显___________性,原因______________________(用离子方程式表示)
K2S溶液中离子浓度由大到小顺序____________________________________________
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是___________________________
(3)在氢硫酸溶液中改变下列条件,使溶液中。c(OH-)、c(S2-)都增大的是______
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(4)已知在常温下 FeS 的Ksp=6.25 ×10-18,H2S饱和溶液中c(H+)与c S2-)之间存在如下关系:c2(H+)·(S2-)= 1.0×10-22 。在该温度下,将适量FeS 入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________ 。
硫化物通常有“废物”之称.硫化物据其溶解性可以分三类:
①易溶于水的有K2S、Na2S、(NH4)2S等;
②易溶于非氧化性强酸、不溶于水的有FeS、ZnS;
③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS、Ag2S、CuS、Cu2S.其中,Ag2S、CuS、Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水(硝酸与盐酸的混合液).氢硫酸溶液中存在下列平衡:
H2S(1)K2S溶液显________性,原因________(用离子方程式表示)K2S溶液中离子浓度由大到小顺序________
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是________
(3)在氢硫酸溶液中改变下列条件,使溶液中.c(OH-)、c(S2-)都增大的是________
A.加入少量的漂白粉
B.通入氨气
C.加入少量过氧化钠粉末
D.加入少量硝酸银溶液
(4)已知在常温下FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与cS2-)之间存在如下关系:c2(H+)·(S2-)=1.0×10-22.在该温度下,将适量FeS入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H+)为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com