
题目列表(包括答案和解析)
下表是四种盐在不同温度下的溶解度(g/100g![]() ):
):
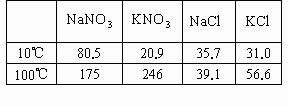
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)某同学设计用物质的量比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图:

(1)在①和③的实验过程中,实验的关键条件是________;
(2)分离出晶体的②和④的操作是________(填“倾倒”、“蒸发”、“结晶”或“过渡”),硝酸钾是晶体________(填“A”或“C”);
(3)粗产品中可能含有的杂质离子是________,检验的方法是___________________________;
(4)欲将粗产品提纯,可采用的方法是________.
下表是四种盐在不同温度下的溶解度(g/100g水):
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:
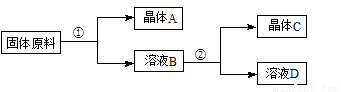
(1)在①和②的实验过程中,需要控制的关键的实验条件是______________________,在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
(3)粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
下表是四种盐在不同温度下的溶解度(g/100g水):
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

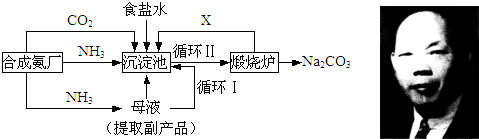
| 温度溶解度盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com