
题目列表(包括答案和解析)
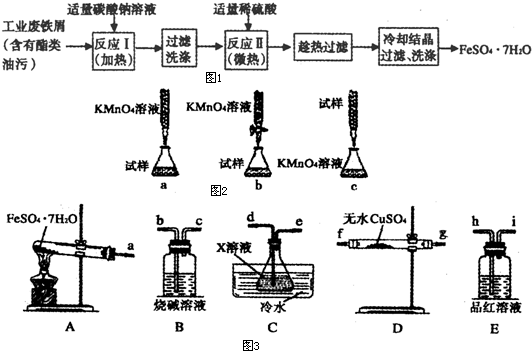
| O | - 4 |
| ||
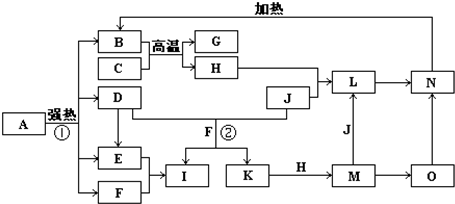
| ||
| ||
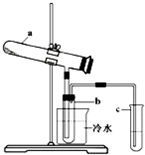 生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
| ||
| ||
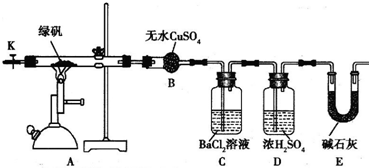
| 实验记录 | 分析或计算结果 | |
| 现象 | 硬质玻璃管内物质由绿色变为红棕色 | 生成物有 |
| 干燥管B中晶体由白色变为蓝色 | 生成物有H2O | |
| 数据 | 称取绿矾样品16.68g | 反应的绿矾的物质的量为0.06mol |
| 干燥管E最后增加的质量2.24g | 生成SO2 | |
| C中生成白色沉淀的质量为4.66g | 生成SO3 0.02mol |
| ||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com