
题目列表(包括答案和解析)
已知短周期元素x、y、z有如下性质:
编号 | X | Y | Z |
原子半径/10―10m | 0.66 | 0.88 | 1.04 |
最高化合价和 最低化合价 |
―2 | +3 | +6 ―2 |
关于短周期元素x、y、z说法错误的是
A.元素x、y位于同一周期 B.元素x、y、z都是非金属元素
C.元素z的氢化物比x的氢化物稳定 D.元素最高价氧化物的水化物酸性y>z
| X | |||
| Y | Z |
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| X | Y | Z |
W |
|
|
|
(1)X元素在元素周期表中的位置___? __________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为_______________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为????????????????????????????? _。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器____(填“能”或“不能”)用来腌制咸菜,原因是_________________________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________。

关于该电池的下列说法,正确的是______
A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平: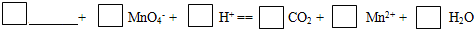 。
。
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| | X | Y | Z |
| W | | | |

 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com