铁及其化合物之间的相互转化可用下式表示:
Fe
2+ Fe
3+ FeO
42-(高铁酸根离子)
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO
4.若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净.可选用的试剂是______(选填序号);
a.Cl
2 b.Fe c.HNO
3 d.H
2O
2(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺.精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS
2+4Fe
3+=Cu
2++5Fe
2++2S.(CuFeS
2中S为-2价)则下列说法正确的是______(选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS
2 既作氧化剂又作还原剂
d.当转移1mol电子时,46g CuFeS
2参加反应
(3)下述反应中,若FeSO
4和O
2的系数比为2:1,试配平下列方程式:FeSO
4+K
2O
2→K
2FeO
4+K
2O+K
2SO
4+O
2↑
(4)高铁酸钾(K
2FeO
4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)
3.高铁酸钾作为水处理剂发挥的作用是______、______.

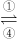 Fe3+
Fe3+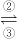 FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子) Fe3+
Fe3+ FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子)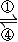 Fe3+
Fe3+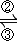 FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子)