
题目列表(包括答案和解析)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 10.0 | 20.0 | 30.0 |
| 生成气体的体积/mL(标准状况) | 89.6 | 179.2 | 224 |
| 16n(H2O2) |
| m(样品) |
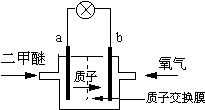 哥本哈根气候变化峰会自2009年12月7日开幕以来,就被冠以“有史以来最重要的会议”、“改变地球命运的会议”等各种重量级头衔.纵然世界各国仍就减排问题进行着艰苦的角力,但低碳这个概念几乎得到了广泛认同.中国慈善首富陈光标2010年11月5号创作的低碳之歌--《让我们再回到从前》让低碳概念融入到每个人的生活之中,减碳是每个人的责任.新能源开发中的燃料电池是低碳研究的重要领域.
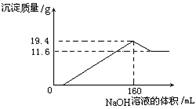
哥本哈根气候变化峰会自2009年12月7日开幕以来,就被冠以“有史以来最重要的会议”、“改变地球命运的会议”等各种重量级头衔.纵然世界各国仍就减排问题进行着艰苦的角力,但低碳这个概念几乎得到了广泛认同.中国慈善首富陈光标2010年11月5号创作的低碳之歌--《让我们再回到从前》让低碳概念融入到每个人的生活之中,减碳是每个人的责任.新能源开发中的燃料电池是低碳研究的重要领域.将一定质量的镁铝合金全部溶于100 mL某浓度的盐酸中。向所得溶液中滴加
5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如右
图所示。则盐酸的物质的量浓度为
(17分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为2L的密闭容器中,充入1molCO2和3.25molH2,在一定条件下发生反应,测定CO2、CH3OH和H2O(g)的浓度随时间变化如图所示:

①写出该工业方法制取甲醇的化学方程式: 。
②从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③反应到达平衡后,再向该容器中通入1 mol CO2和3.25 mol H2,重新到达平衡后,H2的转化率将 (填增大、减小或不变)
④下列措施中一定能使n(CH3OH)/ n(CO2)增大的是: 。
A.向容器中充入一定量的氦气 B.充入CO2
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)可燃性的有机物和氧气在理论上都可以作为燃料电池中的反应物,请写出CH3OH —O2—KOH燃料电池的负极的电极反应式:
(3)若将一定数量的C3H8—O2—KOH燃料电池按一定方式组成电池组以满足电解需要的电压。现用该电池组电解500mL某CuSO4的稀溶液(用铂为电极),电解后的溶液需要加入98克Cu(OH)2才能使溶液恢复到原硫酸铜溶液的浓度和质量。若忽略电池组在电解过程中的能量损失,其能量全部用来电解CuSO4溶液,则:
①原CuSO4溶液物质的量浓度
②该电池组消耗的丙烷在标准状况时的体积
过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
⑴稀硫酸的物质的量浓度c= mol/L。
⑵计算确定过碳酸钠的化学式。
⑶工业上常以所含活性氧的质量分数[w(活性氧)=![]() ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com