
题目列表(包括答案和解析)
| A.标准状况下,10 g O2与10 g O3所含的分子数一定相同- |
| B.标准状况下,将0.1 mol Cl2溶于水中,转移电子数一定为0.1NA |
| C.常温常压下,22.4 L的NO气体分子数小于NA |
| D.标准状况下,11.2 L SO2发生氧化还原反应,一定失去NA 个电子 |
已知:①25℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10.②25℃时,2.0×10-3 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

■(图有问题)
请根据信息回答下列问题:
(1)25℃时,将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1 HSCN溶液分别与20 mL 0.10 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如下图:
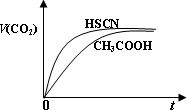
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是________,
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”).
(2)25℃时,HF电离平衡常数的表达式Ka=________,25℃时,HF电离平衡常数Ka________.
(3)25℃时,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生________.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料.
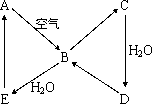
(1)写出A在加热条件下与H2反应的化学方程式________;
(2)写出E与A的氢化物反应生成A的化学方程式________;
(3)写出一个由D生成B的化学方程式________;
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合.
①写出反应的离子方程式________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________.
已知氨水越浓,密度越小,现将20%氨水与10%氨水等体积混合,则混合后溶液的质量分数为
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com