
题目列表(包括答案和解析)
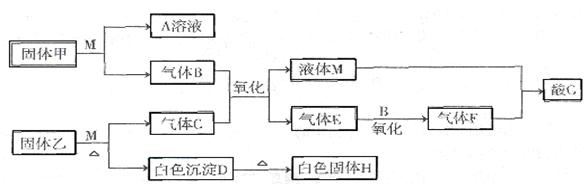
(15分) I 在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。
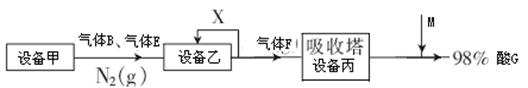
II如图表示的是生产酸G的工业流程:
(1)乙设备的名称为 固体乙的化学式为 M分子的结构式为 。
(2)气体X的主要成分为 。
(3)写出设备甲中常见的化学反应 。
(4)白色沉淀D与G溶液反应的离子方程式为 。
(5)将2.24 L(标准状况下)E通入100mL2 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为____________ ___。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为 当电解时转移2.4mol电子,制得金属 g。
(15分)I在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。
II如图表示的是生产酸G的工业流程:
(1)乙设备的名称为 固体乙的化学式为 M分子的结构式为 。
(2)气体X的主要成分为 。
(3)写出设备甲中常见的化学反应 。
(4)白色沉淀D与G溶液反应的离子方程式为 。
(5)将2.24 L(标准状况下)E通入100 mL2 mol/L A的水溶 液后,溶液中离子浓度由大到小的顺序为____________ ___。
液后,溶液中离子浓度由大到小的顺序为____________ ___。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为 当电解时转移2.4mol电子,制得金属 g。
(15分) I 在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。

II如图表示的是生产酸G的工业流程:

(1)乙设备的名称为 固体乙的化学式为 M分子的结构式为 。
(2)气体X的主要成分为 。
(3)写出设备甲中常见的化学反应 。
(4)白色沉淀D与G溶液反应的离子方程式为 。
(5)将2.24 L(标准状况下)E通入100 mL2 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为____________ ___。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为 当电解时转移2.4mol电子,制得金属 g。
I 在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。

II如图表示的是生产酸G的工业流程:

(1)乙设备的名称为 固体乙的化学式为 M分子的结构式为 。
(2)气体X的主要成分为 。
(3)写出设备甲中常见的化学反应 。
(4)白色沉淀D与G溶液反应的离子方程式为 。
(5)将2.24 L(标准状况下)E通入100 mL2 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为____________ ___。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为 当电解时转移2.4mol电子,制得金属 g。
 液后,溶液中离子浓度由大到小的顺序为____________ ___。
液后,溶液中离子浓度由大到小的顺序为____________ ___。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com