
题目列表(包括答案和解析)
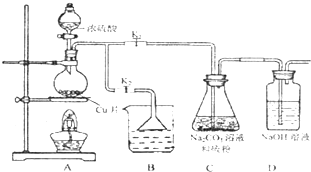 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
2- 7 |
2- 3 |
2- 6 |
下列各组离子一定能大量共存的是 ( )
A.在含有0.1mol/Lca2+的溶液中:Na+、K+、ClO-、Cl-
B.在pH=12的溶液中:NH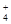 、Na+、SO
、Na+、SO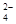 、Cl-
、Cl-
C.在c(H+)=0.1mol/L的溶液中:K+、I-、Cl-、NO
D.在澄清透明的无色溶液中:Na+、Cu2+、Cr2O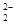 、NO
、NO
下列各组离子一定能大量共存的是 ( )
| A.在含有0.1mol/Lca2+的溶液中:Na+、K+、ClO-、Cl- |
B.在pH=12的溶液中:NH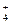 、Na+、SO 、Na+、SO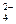 、Cl- 、Cl- |
C.在c(H+)=0.1mol/L的溶液中:K+、I-、Cl-、NO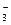 |
D.在澄清透明的无色溶液中:Na+、Cu2+、Cr2O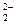 、NO 、NO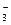 |
|
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康.不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性均为三价铬的100倍.下列叙述错误的是 | |
| [ ] | |
A. |
发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性 |
B. |
K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶 |
C. |
在反应Cr2O |
D. |
污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O |
下列各组离子一定能大量共存的是 ( )
A.在含有0.1mol/Lca2+的溶液中:Na+、K+、ClO-、Cl-
B.在pH=12的溶液中:NH![]() 、Na+、SO
、Na+、SO![]() 、Cl-
、Cl-
C.在c(H+)=0.1mol/L的溶液中:K+、I-、Cl-、NO![]()
D.在澄清透明的无色溶液中:Na+、Cu2+、Cr2O![]() 、NO
、NO![]()
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com