
题目列表(包括答案和解析)
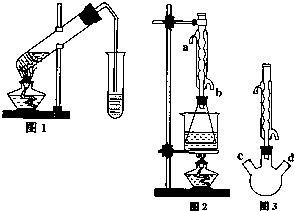 乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸.某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量.
乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸.某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量.| 乙酸乙酯 | 乙醇 | 乙酸 | |
| 沸点 | 77.1℃ | 78.5℃ | 117.9℃ |
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH | 浓硫酸 | △ |

(1)工业上,石油的炼制和加工有多种方法,其中一种方法是通过将石油加热汽化和冷凝液化,得到不同沸点范围的汽油、柴油等石油产品。这种加工方法叫 ________________。
(2)原油炼制前需作脱硫处理,得到的硫可以作为副产品加工成硫酸,若含硫a%的石油100吨,理论上可以得到98%的浓硫酸___________吨。
(3)石油开采和加工过程产生的油田气、炼厂气中含有的“三烯”(乙烯、丙烯、丁二烯)是重要的石油化工原料,以它们为主要原料可以制取许多重要的化工原料。下图中图(Ⅰ)是乙醛的分子结构比例模型,请写出合成图(Ⅱ)模型表示的有机溶剂的化学方程式和反应类型。

(4)液化石油气已作为燃料进入普通家庭厨房,常用的石油气主要是丙烷等多种烃混合物。有人发现石油气钢瓶的残留液体能溶解油脂,将它倒出作洗涤剂。油脂(以硬脂酸甘油酯为例)的结构简式是___________,能溶解在具有相似结构的烃中,但这种做法十分危险,石油气在空气中遇火即燃烧或爆炸,化学方程式为(以丙烷为例)_________________________。
(16分)(Ⅰ)下列实验操作或实验叙述正确的是( )
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
(Ⅱ)红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A、升高温度 B、将原料粉碎 C、增加纯碱的用量 D、通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② | | |
| ③ | | |
| ④ | | |
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
(Ⅰ)下列实验操作或实验叙述正确的是( )
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
(Ⅱ)红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。

①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A、升高温度 B、将原料粉碎 C、增加纯碱的用量 D、通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com