
题目列表(包括答案和解析)
( )
A.CO燃烧的热化学方程式为:2CO(g)+O2(g)![]() 2CO2(g) ΔH=+282.8 kJ·mol-1
2CO2(g) ΔH=+282.8 kJ·mol-1
B.H2燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(g) ΔH=-571.6 kJ·mol-1
2H2O(g) ΔH=-571.6 kJ·mol-1
C.燃烧前混合气体中H2的体积分数为50%
D.燃烧后的混合气体与足量的过氧化钠作用可产生1.25 mol氧气
下列说法或表示方法正确的是( )
A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度
B.31g红磷变成31g白磷要吸收能量,说明白磷比红磷更稳定
C.在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6 kJ/mol
D.2A (l) + B (l) = 2C (l) △H1 2A (g) + B (g) = 2C (l) △H2 则ΔH1>ΔH2
工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g)? △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H=???????????????????????? 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:

①反应在第2 min到第4 min时,O2的平均反应速率为?????????????????? 。
②反应在第6 min时改变了条件,改变的条件可能是????????? (填序号)。
A.使用催化剂????? B.升高温度? C.减小压强????? D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
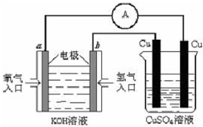
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为____????? 。
②该电池正极的电极反应式为:???????????????????????? 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是?????????????????????????????????? (用相关的离子方程式表示)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com