
题目列表(包括答案和解析)
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.请认真观察下图,然后回答问题.| 1 | 2 |
在化学反应中,只有
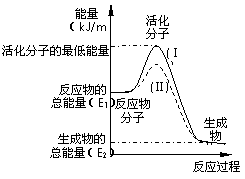 极少数能量比平均能量高得多的反应物分子发生
极少数能量比平均能量高得多的反应物分子发生
碰撞时才可能发生化学反应,这些分子被称![]() 为活
为活
化分子。使普通分子变成活化分子所需提供的最
低限度的能量叫活化能,其单位通常用kJ·mol-1
表示。请认真观察右图,然后回答问题。
(1)图中所示反应是________(填“吸热”
或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________
(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+![]() O2(g) = H2O(g) △H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g) △H = - 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
(9分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
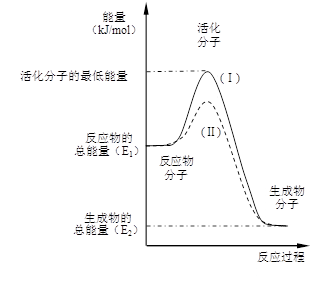
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=________________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ 1/2O2(g)= H2O(g) △H =-241.8kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(12分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。

(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应_____________(填“需要”或“不需要”)加热,该反应的△H=______________________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ O2(g) = ![]() H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(8分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
(1)图中所示反应是_____________(填“吸热”或“放热”)反应,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1。该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com