
题目列表(包括答案和解析)
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为 。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:

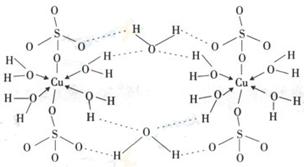
下列说法正确的是 (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH2)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为 ▲ 。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 ▲ 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如下:

下列说法正确的是 ▲ (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 ▲ 。
酞菁也是常见的配位体,结构如右图。该分子中氮原子杂化方式为 ▲ 。 写出与硫酸根离子互为等电子体的分子和离子各一种 ▲ 、 ▲ 。

(5)Cu2O的熔点比Cu2S的 ▲ (填“高”或“低”),
请解释原因 ▲ 。
(12分)已知LiH、NaH及LiAlH4都是常见的金属的氢化物,其中LiAlH4可由下列途径合成: 4LiH + AlCl3 LiAlH4+ 3LiCl。
试探究下列相关问题
(1)下列有关说法正确的是 ▲ 。
A.该反应是氧化还原反应
B.乙醚(C2H5OC2H5)是非极性分子
C.化学性质锂与镁相似,铝与铍相似
D.LiAlH4具有还原性
(2)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构为:
试回答下列问题
①在周期表中Ca处于周期表 ▲ 区。
②铜原子的基态核外电子排布式为: ▲ 。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n= ▲ (填数值);氢在合金中的密度为: ▲ 。
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60。非常适于实际应用。 Ca32C60上可吸附至少92个氢分子(如图)。
有关说法正确的是 ▲ 。
A.钙的第一电离能和电负性均比锶的第一电离能小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时, 储氢质量分数(wt%。)Ca32C60 比Sr32C60高
(12分)已知LiH、NaH及LiAlH4都是常见的金属的氢化物,其中LiAlH4可由下列途径合成: 4LiH + AlCl3
 LiAlH4+ 3LiCl。
LiAlH4+ 3LiCl。
试探究下列相关问题
(1)下列有关说法正确的是 ▲ 。
A.该反应是氧化还原反应
B.乙醚(C2H5OC2H5)是非极性分子
C.化学性质锂与镁相似,铝与铍相似
D.LiAlH4具有还原性
(2)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构为:

试回答下列问题
①在周期表中Ca处于周期表 ▲ 区。
②铜原子的基态核外电子排布式为: ▲ 。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n= ▲ (填数值);氢在合金中的密度为: ▲ 。
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60。非常适于实际应用。 Ca32C60上可吸附至少92个氢分子(如图)。

有关说法正确的是 ▲ 。
A.钙的第一电离能和电负性均比锶的第一电离能小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时, 储氢质量分数(wt%。)Ca32C60 比Sr32C60高
已知LiH、NaH及LiAlH4都是常见的金属的氢化物,其中LiAlH4可由下列途径合
成: 4LiH + AlCl3 ![]() LiAlH4+ 3LiCl。
LiAlH4+ 3LiCl。
试探究下列相关问题
(1)下列有关说法正确的是 ▲ 。
A.该反应是氧化还原反应
B.乙醚(C2H5OC2H5)是非极性分子
C.化学性质锂与镁相似,铝与铍相似
D.LiAlH4具有还原性
(2)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构为:

试回答下列问题
①在周期表中Ca处于周期表 ▲ 区。
②铜原子的基态核外电子排布式为: ▲ 。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n= ▲ (填数值);氢在合金中的密度为: ▲ 。
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60。非常适于实际应用。 Ca32C60上可吸附至少92个氢分子(如图)。

有关说法正确的是 ▲ 。
A.钙的第一电离能和电负性均比锶的第一电离能小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时, 储氢质量分数(wt%。)Ca32C60 比Sr32C60高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com