
题目列表(包括答案和解析)

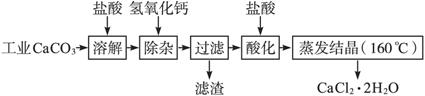
(13分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的PH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是__________。
(2) 酸化操作是加入盐酸,调节溶液的PH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③__________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250mL 容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有__________。
②计算上述样品中CaCl2·2H2O的质量分数为__________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________;__________。
(13分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
(1)除杂操作是加入氢氧化钙,调节溶液的PH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是__________。
(2) 酸化操作是加入盐酸,调节溶液的PH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③__________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有__________。
②计算上述样品中CaCl2·2H2O的质量分数为__________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________;__________。
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是__________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③__________________。
(3)测定样品中Cl-含量的方法是:a.称取0.750
①上述测定过程中需用溶液润洗的仪器有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有____________________;____________________。
15. (10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量
Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为
97.0%~103.0%)的主要流程如下:
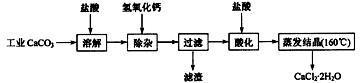 |
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量
Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量
Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶
中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3 溶液
滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有: 。
②计算上述样品中CaCl2·2H2O的质量分数为: 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可
忽略),其可能原因有: ; 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com