
题目列表(包括答案和解析)
液体,Z是一种有刺激性气味、极易溶于水的气体。有关的转化关系如下(反应条件均已略去):
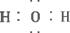
回答下列问题:
(1)写出X的化学式_________;Y的电子式_________。
(2)Z与N反应生成化合物的水溶液呈_________(选填“酸性“中性”“碱性”)。
(3)请写出C的稀溶液与N的稀溶液反应的热化学方程式(已知中和热为57.3 kJ·mol-1)
___________________________________________________。

(8分)已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的组成元素的离子半径是第三周期元素中离子半径最小的。N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
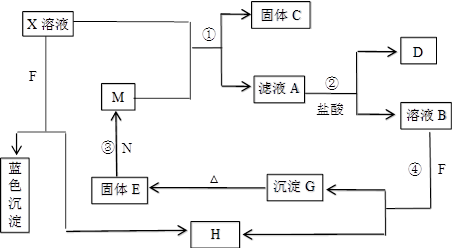
请回答下列问题:
(1)X的化学式为 ;F的电子式为 。
(2)反应②的离子方程式为_______________________________________________。
反应③的化学方程式为_______________________________________________。
(3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干
得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。(假设体积不变)
(15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为354%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
①写出D与X反应的化学方程式
②写出G与H反应的离子方程式。
③实验室中I应如何保存?。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
(15分)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为354%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。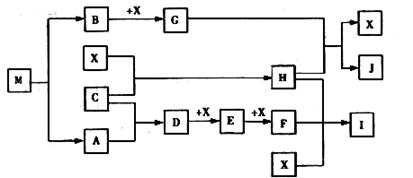
 ①写出D与X反应的化学方程式
①写出D与X反应的化学方程式 ②写出G与H反应的离子方程式。
②写出G与H反应的离子方程式。
③实验室中I应如何保存?。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com