
题目列表(包括答案和解析)
(1)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的多原子分子M、N、W,且在M、N、W分子中,A、B、C原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为_____ (用元素符号表示)。A22-与C22+互为等电子体,C22+的电子式__________
②N的沸点比其同族相邻氢化物沸点高的主要原因是_____。W分子的空间构型的名称是_________
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①F元素基态原子电子排布式为_____
②E元素单质的晶体堆积模型为_____(填字母)
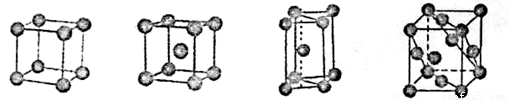
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
③向G的硫酸盐溶液中通入过量N气体,可生成[G(N)4]2+不考虑空间构型,[G(N)4]2+
的结构可用示意图表示为_____ (用元素符号表示)。

(1)我国首创以E(单质)—(空气,海水)—石墨(C)电池为能源的新型海水标志灯。该灯以海水为电解质溶液,靠空气中的氧气使E(单质)不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光,其能量比干电池高20—50倍。该电池的正极反应式是________________________________________________。
(2)将过量气体AF通入AgNO3溶液中得到白色沉淀,将此白色沉淀分成4等份并分别溶于下列物质中:①10 mL水 ②10 mL 0.1 mol·L-1的NaCl溶液 ③10 mL 0.1 mol·L-1的MgCl2溶液 ④10 mL 0.1 mol·L-1的KI溶液。则所得溶液中剩余白色固体质量由大到小的顺序为(填序号)________________________________________________。
(3)已知:
B2(g)+
B2(g)+
试写出BA3与C2反应生成BC2和A
(4)3 mol A的单质与1 mol B的单质在一个体积恒定的密闭容器中反应,生成化合物M,达到平衡时,M的体积分数为m。若将a mol A的单质、b mol B的单质、c mol M同时置于上述容器中,在相同温度下反应,达到平衡时,M的体积分数仍为m,则a、b、c必须满足的关系是____________________________________________________。
(15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有 (填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是 。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
mol•L-1•min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③
A、B、C、D、E、F是原子序数依次递增的前四周期元素。其中A与D同主族、C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2∶3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液变红。据此回答下列问题:
(1)F元素形成的高价基态离子的核外电子排布式为 ;C、D、E三元素原子均能形成简单离子,其离子半径大小顺序为 (用离子符号表示);
(2)A与C形成的10电子分子中含的化学键类型为 (填σ键或π键),分子中心原子的轨道杂化类型为 ,其化合物晶体类型为 ;化合物A2C和A2E中,沸点较高的是 (填分子式);
(3)向含1 mol A2E的水溶液中加入等物质的量的D2C2,有黄色沉淀生成,写出离子方程式 :
(4)常温常压下,有23 g液态化合物B2A6C与足量的C的单质充分反应,生成BC2气体和A2C液体,同时放出683.5 kJ的热量,该反应的热化学方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com