
题目列表(包括答案和解析)
已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)

A的结构式 ,E的化学式为 ;
在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填序号)
写出下列反应的化学方程式② ④
将含有1.2molH的水溶液调节至中性, 通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为 。
已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态。D为常见金属单质,少量D与足量X的浓溶液在常温下无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)

(1)A的结构式 ,E的化学式为 ;
(2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为 (填反应序号)
(3)写出下列反应的化学方程式② ④
已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态.D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生.(相关转化中所有反应物与生成物均已标出)

(1)A的电子式________,E的化学式为________;
(2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为________(填序号)
(3)写出②的化学方程式________.
(4)写出⑥的离子方程式________.
(5)将含有1.2 mol H的水溶液调节至中性,通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为________g.
已知化合物A与B,M与N的元素组成相同,且四种物质中含有同一种元素,A与B在常温下均呈液态.D为固体单质,与X的浓溶液在常温作用无明显现象,加热时有大量气体产生.(相关转化中所有反应物与生成物均已标出)

(1)A的电子式________,E的化学式为________;
(2)在①至⑥的化学反应中,属于氧化还原反应的化合反应为________(填序号)
(3)写出②的化学方程式________.
(4)写出⑥的离子方程式________.
(5)将含有1.2 mol H的水溶液调节至中性,通入足量C充分反应,生成红褐色沉淀且溶液呈黄色,经过滤、洗涤、灼烧至恒重,称量所得固体的质量为________g.
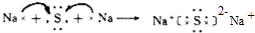
| 1 |
| 2 |
| 1 |
| 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com