
题目列表(包括答案和解析)
(16分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
(1)孔雀石研磨的目的是 。浸泡孔雀石的试剂A若选用过量的稀硫酸,则产生的气体a是 (填化学式)、固体a是 (填化学式)。
(2)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用 (填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
相应的化学反应方程式: 。
(3)试剂C的使用目的是调节溶液pH,使Fe3+转化为沉淀予以分离。试剂C宜选用 (填选项序号)。
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
相应的离子方程式 。
(4)1 mol氨气通过加热的Cu2(OH)2 CO3可以产生1.5 mol金属铜,发生反应的化学方程
式: 。
(5)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3 mol/L,必需将溶液pH调节至 。
(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示): ;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S)Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp= 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1。
(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示): ;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp
= 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是
(填写序号);②中氯离子的浓度为
mol·L-1。
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp
= 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是
(填写序号);②中氯离子的浓度为
mol·L-1。
(16分)(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)= CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)= 2H2O(1) △H<0
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
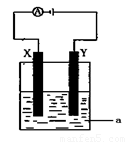
①若a为CuSO4溶液,则电解时的化学反应方程式为 。通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的状态,则电解过程中转移的电子的物质的量为
②若电解含有1molNaCl溶液400ml,当阳极产生的气体448mL(标准状况下)时,溶液的C(OH—) = (假设电解后溶液体积不变)。
(16分)(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)= CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)= 2H2O(1) △H<0
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为 。通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的状态,则电解过程中转移的电子的物质的量为
②若电解含有1molNaCl溶液400ml,当阳极产生的气体448mL(标准状况下)时,溶液的C(OH—) = (假设电解后溶液体积不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com