
题目列表(包括答案和解析)
物质A、B、C有如下转化关系:

请回答下列问题:
(1)若A、B、C均为含铝元素的化合物,M可以是 。
(2)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子,请写出C的名称 ![]()
(3)若A是一种黄绿色气体,M是一种常见金属。写出C→B的离子方程式
。
(4)若A、B、C都是含硫化合物,已知:
A转化为B的热化学方程式:2H2S(g)+ O2(g) =2S (s)+2H2O(l) △H= -a kJ·mol-1;
A转化为C的热化学方程式:2H2S(g)+ 3O2(g) =2SO2(g)+2H2O(l) △H = -b kJ·mol-1;
请写出A与C反应转化为B的热化学方程式 。
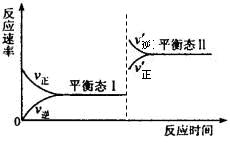
(5)若C+A→B的转化关系为4NH3+6NO![]() 6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系如图。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)
6H2O+5N2。在一定条件下,该反应达到平衡态I后,升高温度平衡发生移动,达到平衡态II的反应速率随时间变化的关系如图。该反应为 (填“吸热”或“放热”)反应;升高温度,该反应的平衡常数K值 (填“增大”、“减小”或“不变”)![]()
 物质A、B、C有如图1转化关系:
物质A、B、C有如图1转化关系:(1)2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(2)2Fe2O3+3C![]() 4Fe+3CO2
4Fe+3CO2
(3)3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
(4)HgS+O2![]() Hg+SO2
Hg+SO2
(5)2H2S+SO2![]() 3S+2H2O
3S+2H2O
 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | — |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
分析下列氧化还原反应中化合价的变化关系,注明电子转移方向和总数,并指出氧化剂和还原剂,氧化产物与还原产物,属于四种基本反应类型的具体指出其反应类型.
(1)2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(2)2Fe2O3+3C![]() 4Fe+3CO2
4Fe+3CO2
(3)3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
(4)HgS+O2![]() Hg+SO2
Hg+SO2
(5)2H2S+SO2![]() 3S+2H2O
3S+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com