
题目列表(包括答案和解析)
CoCl2•xH2O与Na2CO3•10H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO3•10H2O的质量为_______ g(保留2位小数)。
(2)CoCl2•xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为 。
CoCl2•xH2O与Na2CO3•10H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO3•10H2O的质量为_______ g(保留2位小数)。
(2)CoCl2•xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为 。
(14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴写出铬的原子结构示意图为 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。

⑵ CCl4分子中C原子采取 杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号)
a.2个σ键 b.2个π键 c.1个σ键、1个π键

⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。
(10分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
(2)CCl4分子中C原子采取 杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。

研究物质的微观结构,有助于人们理解物质变化的本质。请回答:
(1)C、Si、N元素的电负性由大到小的顺序是 ,C60和金刚石都是碳的同素异形体,金刚石熔点高于C60的熔点,原因是 ;
(2) A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式 ;
|
电离能/kJ•mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”);
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
① COCl2分子的结构式为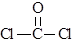 ,COCl2分子内含有
(填标号);
,COCl2分子内含有
(填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
② Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com