
题目列表(包括答案和解析)
(10分)CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) 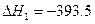 kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) 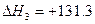 kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的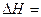 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) 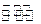 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。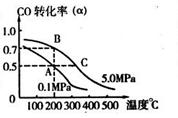
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,
在催化剂作用下反应生成甲醇:
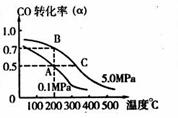
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )
)
与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,
则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
(2)在10L密闭容器中充有10 molCO 与20molH2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。
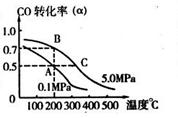
①若A、B两点表示在某时刻达到的平衡状态,则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
 kJ·mol-1
kJ·mol-1 kJ·mol-1
kJ·mol-1 。
。 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
| 1 |
| 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com