某种胃药中抗酸剂为CaCO
3.甲、乙两同学为测定其中CaCO
3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
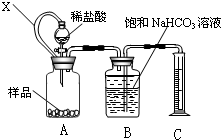
(1)甲同学拟用右图装置测量样品与足量稀盐酸反应生成CO
2的体积,来分析CaCO
3的含量.则①X的作用是
使广口瓶内与分液漏斗内气体压强相等,便于溶液顺利流下
使广口瓶内与分液漏斗内气体压强相等,便于溶液顺利流下
②B中不可改用饱和Na
2CO
3溶液,用离子方程式说明理由
CO32-+CO2+H2O=HCO3-
CO32-+CO2+H2O=HCO3-
(2)乙同学拟用以下操作测定样品中CaCO
3含量:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20mL蒸馏水
C.加入30mL 0.100mol/L 的盐酸,充分反应
D.用0.100mol/L NaOH溶液中和过量的盐酸至中性,共消耗NaOH溶液18.00mL
试回答下列问题:
①配制0.100mol/L HCl溶液100mL需要的玻璃仪器是
100mL容量瓶、烧杯、胶头滴管、玻璃棒
100mL容量瓶、烧杯、胶头滴管、玻璃棒
②该胃药中CaCO
3的质量分数是
60%
60%
(3)甲同学将实验中获得的17.92mL CO
2 (标准状况)通入10mL 0.100mol/L NaOH溶液中,判断所得溶液的溶质是
Na2CO3、NaHCO3
Na2CO3、NaHCO3
(填化学式)

 某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题: