
题目列表(包括答案和解析)
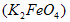 易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解
易溶于水,具有强氧化性,是一种新型水处理剂。工业上常用如下方法制备高铁酸钾:以铁丝网为阳极电解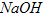 溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。
溶液,然后在阳极液中加入50%的KOH溶液,充分反应后,过滤、用异丙醇洗涤、干燥,即可制得。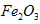 作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、
作阳极的电极反应式为________________;若通过相同的电流,分别用铁丝网、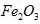 作阳极制得的高铁酸钾的质量之比为_____________。
作阳极制得的高铁酸钾的质量之比为_____________。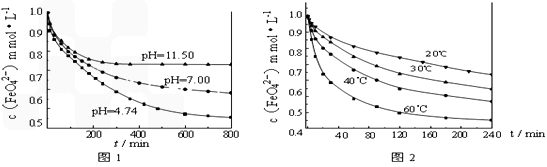
 4Fe(OH)3+8OH-+3O2↑。由图1可知,
4Fe(OH)3+8OH-+3O2↑。由图1可知,高铁酸钾(K2FeO4)具有极强的氧化性,因该物质具有“绿色”、选择性高、活性强等特点受到人们关注。
(1)高锰酸钾制备方法之一为:
①在一定温度下,将氯气通入KOH溶液中制得含有次氯酸钾的溶液;
②在剧烈搅拌条件下,将Fe(NO3)3分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;
③甲KOH至饱和,使K2FeO4充分析出,再经纯化得产品,其纯度在95%以上。
①氯碱工业中制备氯气的化学方程式是 ;
②温度过高会导致次氯酸钾自身分解生成两种化合物,产物之一是氯酸钾(KclO3),另一种产物应该是 (写化学式)。
③制备过程有一步反应如下,请配平方程式(将计量数填入方框中):
![]()
(2)为探究高铁酸钾的某种性质,进行如下两种实验:
实验一:将适量K2FeO4分别溶解于pH为4.74、7.00、11.50的水溶液中,配的FeO42―浓度为1.0m mol?L―1(1 m molL―1=1×103 mol?L―1)的试样,分别静置800min,考查初始pH不同的水溶液对K2FeO4某种性质的影响,结果见图1。
实验二:将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42―浓度为1.0m mol?L―1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,考查不同温度对K2FeO4某种性质的影响,结果见图2。
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为:FeO42―+10H2O![]() 4Fe(OH)3+8OH―+3O2↑
4Fe(OH)3+8OH―+3O2↑
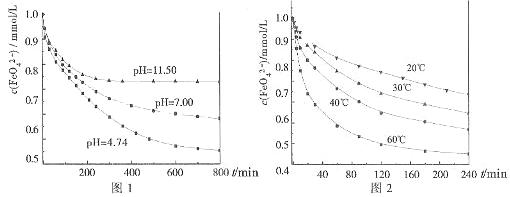
由图1可知,800min时,初始pH=11.50的溶液中,高铁酸钾的最终浓度比pH=4.74的溶液中高,主要原因是 。
| O | 2- 4 |
高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性。
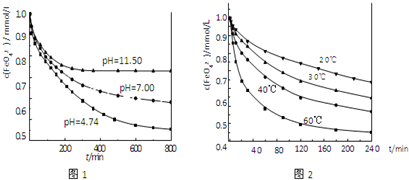
(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol·L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示。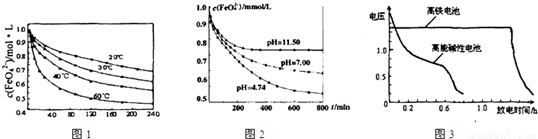
该实验的目的是_______________________;FeO42-发生反应的△H____________0(填“>”“<”或“=”)
(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol·L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图像见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是______________。
(3)电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明 。电解时阳极发生反应生成FeO42-,该电极反应式为______________。
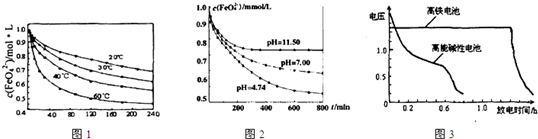
(4)与MnO2—Zn电池类似,K2FeO4—Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为_______________。图3为高铁酸钾电池和高能碱性电池放电曲线,由此可得出的高铁酸钾电池的优点有_______________________、________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com