
题目列表(包括答案和解析)
食盐、碳酸钠和碳酸氢钠是生活中常见的钠盐。请回答下列问题。
(1)碳酸氢钠的水溶液显__________性。(填“酸”、“碱”或“中”)。除去碳酸钠固体中混有的少量碳酸氢钠,反应的化学方程式为_________________。
(2)等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成的CO2量,前者________后者(填“>”、“<”或“=”)。
(3)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等)。用粗盐制取“化学纯”级的NaCl,步骤为溶解、加过量a、加过量NaOH、加过量b、过滤、加适量盐酸,蒸发结晶得到“化学纯”级的NaCl固体。试剂a、b分别是________(填序号)
A.Na2CO3 BaCl2 B.BaCl2 Na2CO3 C.BaCl2 Na2SO4
(4)工业上用电解饱和食盐水的方法生产氯气和烧碱。
①某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理_________________________________(用离子方程式表示)。
②工业上可用氨检验输送氯气的管道是否漏气。反应方程式如下: 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
食盐、碳酸钠和碳酸氢钠是生活中常见的钠盐。请回答下列问题。
(1)碳酸氢钠的水溶液显__________性。(填“酸”、“碱”或“中”)。除去碳酸钠固体中混有的少量碳酸氢钠,反应的化学方程式为_________________。
(2)等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成的CO2量,前者________后者(填“>”、“<”或“=”)。
(3)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等)。用粗盐制取“化学纯”级的NaCl,步骤为溶解、加过量a、加过量NaOH、加过量b、过滤、加适量盐酸,蒸发结晶得到“化学纯”级的NaCl固体。试剂a、b分别是________(填序号)
A.Na2CO3 BaCl2 B.BaCl2 Na2CO3 C.BaCl2 Na2SO4
(4)工业上用电解饱和食盐水的方法生产氯气和烧碱。
①某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理_________________________________(用离子方程式表示)。
②工业上可用氨检验输送氯气的管道是否漏气。反应方程式如下:
 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。卤水中的主要成分为食盐(假设其所含杂质仅为NaBr),为了充分利用资源,有研究人员开发了以晒盐卤水和化肥碳酸氢铵为原料制取纯碱的工艺,其生产流程如下图.
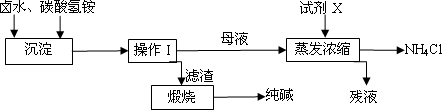
(1)写出卤水和碳酸氢铵反应的化学方程式________;
(2)操作I是________(填操作名称),试剂X为________,残液除NH4Cl外,还含有________;
(3)若滤渣中含有NH4Cl杂质,则可能导致纯碱中混有杂质,写出煅烧时产生杂质的副反应的化学方程式________;
(4)实验室检测滤渣中是否含有NH4Cl的操作是________;
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,如图是![]() (摩尔比)对NaHCO3产率的影响.实际生产中选择
(摩尔比)对NaHCO3产率的影响.实际生产中选择![]() =1.2.
=1.2.
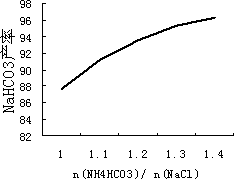
①下列相关说法正确的是________.
a.碳酸氢铵过量是为了充分利用卤水
b.碳酸氢铵过量是为了减少纯碱中的NaCl
c.碳酸氢铵过量太多将会导致生产成本过高
②不考虑生产过程中的损耗,生产1 mol纯碱,需消耗碳酸氢铵________mol.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com