
题目列表(包括答案和解析)
|
已知 ① ② ③ ④ | |
| [ ] | |
A. |
①② |
B. |
①③ |
C. |
②④ |
D. |
③④ |
|
已知 ① ② ③ ④ | |
| [ ] | |
A. |
①② |
B. |
①③ |
C. |
②④ |
D. |
③④ |
|
已知:
Δ H=234.1 kJ·mol-1C(s)+O2(g)=CO2(g) Δ H=-393.5 kJ·mol-1则 2Fe(s)+ | |
| [ ] | |
A. |
- 824.4 kJ·mol-1 |
B. |
- 627.6 kJ·mol-1 |
C. |
- 744.7 kJ·mol-1 |
D. |
- 169.4 kJ·mol-1 |
|
已知c(H+)=1×10-3 mol·L-1的一元酸HX溶液和c(OH-)=1×10-3 mol·L-1的一元碱YOH溶液混合后溶液呈中性,下列判断正确的是 | |
| [ ] | |
A. |
若HX是弱酸,YOH是强碱,则两溶液浓度相等 |
B. |
若HX是强酸,YOH是弱碱,则两溶液体积相等 |
C. |
若HX是弱酸,YOH是强碱,则两溶液体积一定是V(HX)>V(YOH) |
D. |
在混合后的中性溶液中,c(X-)=c(Y+) |
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;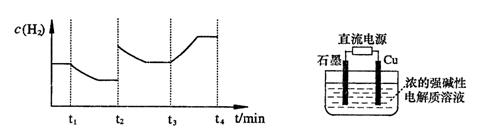
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
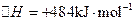 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
(2)已知: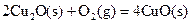 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 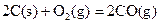 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式 ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com