
题目列表(包括答案和解析)
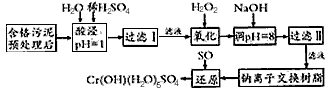

 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+  H2O=
H2O= Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;(15分)现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。![]() 已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
![]() ②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
![]() ③C的氢化物分子G是具有10电子微粒,且以发生下列转化
③C的氢化物分子G是具有10电子微粒,且以发生下列转化
![]()
![]() G
G  P
P  Q
Q  M+P
M+P
![]() ④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
![]() ⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)B元素的名称是 ;
(1)B元素的名称是 ;
![]() (2)E元素的原子结构示意图是 。
(2)E元素的原子结构示意图是 。
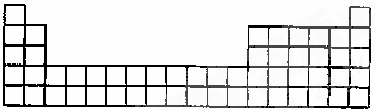
![]() (3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
![]()
|
![]() (4)G的电子式为 。化合物X所含化学键类型有 。
(4)G的电子式为 。化合物X所含化学键类型有 。
![]() (5)A的氧化物与NaOH溶液反应的离子方程式:
(5)A的氧化物与NaOH溶液反应的离子方程式:
![]() T与F单质的水溶液反应的离子方程式为 ;
T与F单质的水溶液反应的离子方程式为 ;
![]() G与D的单质反应的化学方程式为 ;
G与D的单质反应的化学方程式为 ;
![]() M与铜反应的化学方程式为 。
M与铜反应的化学方程式为 。
(15分)现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
③C的氢化物分子G是具有10电子微粒,且以发生下列转化

④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
![]() ⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
![]() 请回答下列问题:
请回答下列问题:
![]() (1)B元素的名称是 ;
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 。
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
|
(4)G的电子式为 。化合物X所含化学键类型有 。
(5)A的氧化物与NaOH溶液反应的离子方程式:
T与F单质的水溶液反应的离子方程式为 ;
G与D的单质反应的化学方程式为 ;
M与铜反应的化学方程式为 。
现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
③C的氢化物分子G是具有10电子微粒,且以发生下列转化



G P Q M+P
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 。
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
(4)G的电子式为 ,属于 分子(填“极性”或“非极性”),用离子方程式表示G使红色石蕊试液变蓝的因: 。
化合物X所含化学键类型有 。
(5)A的氧化物与NaOH溶液反应的离子方程式: 。
T与F单质的水溶液反应的离子方程式为 ;
G的水溶液与足量的T反应的化学方程式为 ;



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com