
题目列表(包括答案和解析)
 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 |
均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
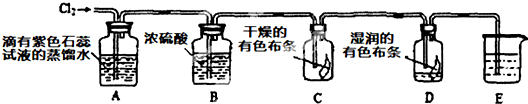
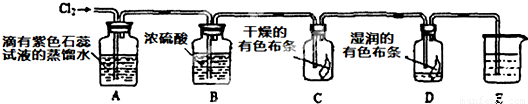
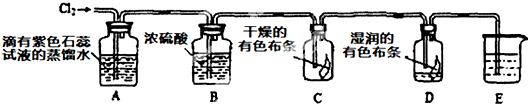
某兴趣小组根据金属镁与C02的反应,推测金属钠也能与C02发生反应,因此
他们用下图所示的装置进行“钠与C02反应”的探究(尾气处理装置略去).又知实
验过程中的C02气体为足量;设能发生的反应都进行完全;一氧化碳气体可用氯化钯
(PdCl2)溶液来检验(通过溶液颜色的变化来判断)。
(1)为了使制取气体的装置能“随开随用,随关随停”,则在图中A处应选用的装置是 (填“I”、“Ⅱ”或“Ⅲ”).若要用干燥、纯净的C02气体与金属钠反应,则装置B中应盛放的试剂是 溶液。
(2)实验开始,检查装置的气密性完好并装入有关药品后,在点燃酒精喷灯前,还必须进行的实验操作是 。
(3)反应完成后,装置D玻璃管中残留的固体物质可能是 。(填字母) .Na202 b.Na2C03 c.NaHCO3 d.Na2C03和C
.Na202 b.Na2C03 c.NaHCO3 d.Na2C03和C
(4)若D玻璃管中残留的固体是纯净物,则钠与C02反应的化学方程式是 。
(5)请设计合理的实验来检验某固体物质是Na2C03.答: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com