
题目列表(包括答案和解析)
氧化还原综合题:
氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:
NO3-+4H++3e- NO+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.
NO+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的方程式:________.
(2)反应中硝酸体现了________、________性质.
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是________mol.
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:________.
(5)KMnO4在酸性溶液中发生还原反应的反应式:________.
 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
| 催化剂 |
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中________________能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。
如:CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
据此回答:若用标准状况下
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4·2H2O)。写出有关的化学反应方程式______________。
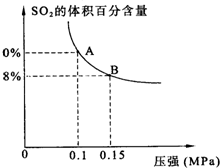
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1

某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如上图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系____________(填“吸收”或“释放”)能量。
②将5 mol SO2和7 mol O2通入
 2SO3(g)△H=-196.kJ?mol-1
2SO3(g)△H=-196.kJ?mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com