
题目列表(包括答案和解析)
(1)若在相同温度下,分别在
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5 mol 氩气,则N2的转化率会起什么变化?正反应速率与原平衡相比,有无变化,简答理由。
(3)若在
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)若在相同温度下,分别在
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩尔氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在
①若x=0,y=0,则z=_____________。
②若x=0.75,则y应为_____________mol、z应为_____________mol。
③x、y、z应满足的一般条件是______________________________________。
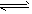 2E(g),若开始时只充入2 molE,达到平衡时,混合气体的压强比起始时增大了20%;计算达到平衡时M的体积分数。
2E(g),若开始时只充入2 molE,达到平衡时,混合气体的压强比起始时增大了20%;计算达到平衡时M的体积分数。 | 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
 a
a湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com