
题目列表(包括答案和解析)
回答下列问题:

(1)若要检验该产物中是否存在亚硫酸钠,你设计的实验方案是___________________。
(2)若要进一步检验该产物中是否存在硫酸钠,请你简述操作方法______________________。
(3)若实验前测得Na2O2的质量为m1 g,实验后冷却至室温,测得固体的质量为m2g,请你从定量测定的角度分析,当两种产物都有时,m2的取值范围是(用m1来表示) ________________。该试样中亚硫酸钠的质量分数的计算式为(用m1、m2来表示) ____________________。
(4)取m g上述反应后的固体,请你简述一种实验方法测定该试样中亚硫酸钠的质量分数:
________________________________________________。
某化学实验小组的同学为探究过氧化钠与二氧化硫反应的白色固体产物是Na2SO3还是Na2SO4,用如下图所示的装置进行实验。通入足量的SO2气体,将带余烬的木条插入试管C中。请回答下列问题:
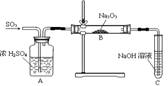
(1)如果木条复燃,写出B中发生反应的化学方程式 ;
如果木条始终未复燃,写出B中发生反应的化学方程式 。
(2)请设计一种实验方案验证B中的白色固体产物是Na2SO3还是Na2SO4。
(3)若实验前称得Na2O2的质量为m1,充分反应后称得生成固体的质量为m2,也可通过计算判断反应后固体的成分。请写出判断的依据(用含m1、m2的关系式表示)。
(4)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理?______________。请简要说明两点理由:①________________________________;②________________________________。
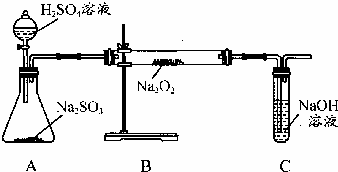 某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题
某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题(12分)某化学兴趣小组的同学为探究过氧化钠与二氧化硫的反应,用如下图所示的装置进行实验。将带余烬的木条插入试管D中,木条复燃。

请回答下列问题:
(1)写出装置A中反应的离子反应方程式 ▲ 。将带余烬的木条插入试管D中,木条复燃,说明在装置C中反应后产生的气体是 ▲ 。
(2)装置B的作用是 ▲ 。若去掉装置B则 ▲ (填“能”或“不能”)证明装置C中产生的气体是由SO2和Na2O2反应所得,原因是: ▲ 。
(3)有同学认为Na2O2与SO2反应方程式为:2Na2O2+2SO2=2Na2SO3+O2。也有同学认为除了生成Na2SO3和O2外,还有Na2SO4生成。你认为生成Na2SO4的理由是: ▲ 。
二氧化硫(SO2) 在通常情况下是一种无色刺激性气味的有毒气体,它能与氢氧化钠溶液反应,生成盐和水,现有某一实验小组的同学欲利用下图装置和药品制SO2 。并对SO2 与水在通常情况下能否反应,进行实验探究,设计的探究过程如下。请回答其中的有关问题:
(1)假设:SO2与水在通常情况下能反应,生成物是一种酸。
(2)设计方案:先验证水能否使蓝色石蕊试纸变红;再验证SO2 气体能否使干燥的蓝色石蕊试纸变色;最后验证SO2 气体能否便湿润的蓝色石蕊试纸变红。
(3)查阅资料:你认为该研究小组需要查阅的资料内容包括 。
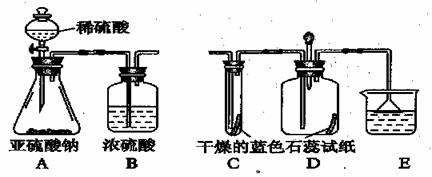
①二氧化硫易溶于水;②酸能使紫色石蕊试纸变红; ③二氧化硫能用浓硫酸干燥。
(4)实验:①实验过程中;装置C 内的石蕊试纸的颜色始终没有变化,这说明
②装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸发生颜色变化,当有SO2 气体通过时,发现湿润的蓝色石蕊试纸变化。此现象说明 __________________________________。
③装置E 的作用是 __,
写出发生反应的化学方程式 ________
(5) 结论:原假设 (填“成立”或“不成立”) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com