
题目列表(包括答案和解析)
(16分)化学发展史上,有许多偶然事件引起科学发现的事例,碘的发现也得益于Courtoris对意外现象的注意。碘是人类发现的第二个生物必需微量元素,它以碘化物形式存在于海水、海藻及人体甲状腺中。人类缺碘会引起甲状腺肿大,我国已全面实施加碘盐方案。
3-1 单质碘的制备方法之一是在酸性条件下通Cl2于NaI溶液中,指出运用该法时应注意的问题?分析其原因,写出有关反应方程式。
3-2 在100%硫酸中,I2可被HIO3氧化成I3+,写出配平的离子方程式。
3-3 为什么在日照强、温度高的海区,表层水碘浓度往往要低一些?
3-4 人体缺碘会影响正常的生命活动。儿童缺碘会造成身体畸形,智力低下。成年人缺碘会因新陈代谢能力降低而导致全身无力,提早出现衰老现象。为提高人体素质,食物补碘已引起人们的重视。据报道,人从食物中摄取碘后便在甲状腺中积存下来,通过一系列化学反应形成甲状腺素。甲状腺素的结构:
(1)写出甲状腺素的化学式 ;
(2)在甲状腺内,甲状腺素的主要合成过程如下:
A(氨基酸)![]() B
B![]() 甲状腺素+C(氨基酸)
甲状腺素+C(氨基酸)
请写出A、B、C的结构简式。
3-5 科研表明,人的一生只要能摄入一小茶匙的碘就能正常发育,健康生活。目前预防缺碘的有效办法是食用含碘食盐。目前国内食盐加碘加的主要是碘酸钾。
(1)写出工业上以KI为原料制备碘酸钾的化学方程式;
(2)如何用简易操作检验食盐是否加碘。写出离子反应方程式。
3-6 已知反应H2+I2![]() 2HI,分两步完成I2
2HI,分两步完成I2![]() 2I H2+2I
2I H2+2I![]() 2HI
2HI
式中k,k1,k2,k3是分别为各反应相应的速率常数,若用Ea,E1,E2,E3分别表示各反应相应的活化能,请找出Ea和E1,E2,E3间的关系。已知公式如下:
①对于反应aA+bB→eE+f F,反应速率为:v=k[A]a[B]b
②速率常数与活化能之间满足阿仑尼乌斯公式:k=Ae-Ea/RT
③对于反应I2![]() 2I满足:v正=v逆
2I满足:v正=v逆
| A、在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量 | B、1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ | C、该反应的逆反应是放热反应 | D、该反应过程的能量变化可用如图来表示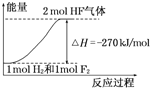 |
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
| A、在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | B、1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ | C、该反应的逆反应是放热反应 | D、该反应过程的能量变化可用如图来表示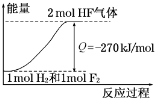 |
 煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源.| 物质 | H2 | CO | CO2 | (CH3)2O | CH3OH | H2O |
| 体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com