
题目列表(包括答案和解析)
(16分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下: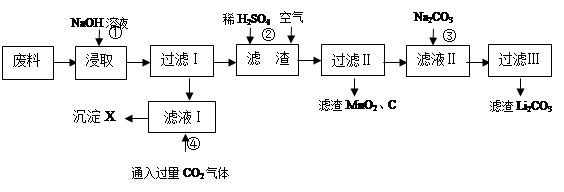
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是 。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______ __ 。
(3)写出反应④生成沉淀X的离子方程式:
。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
。
(5)生成Li2CO3的化学反应方程式为______ __。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应_ _。
(16分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
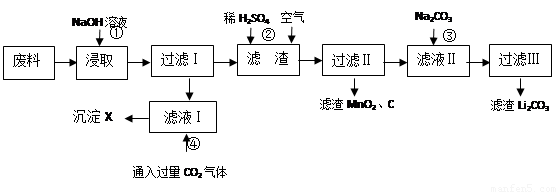
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是 。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______ __ 。
(3)写出反应④生成沉淀X的离子方程式:
。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
。
(5)生成Li2CO3的化学反应方程式为__ ____ __。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应_ _。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com