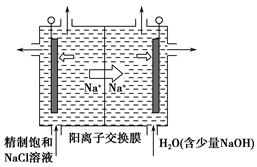
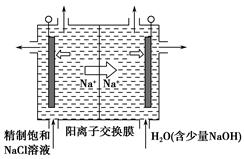
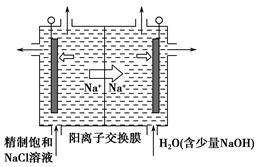
I.海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
(1)目前国际上使用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化).
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”.氯气的工业制取装置如图1,回答:
①若饱和食盐水中含有酚酞,通电后
a
a
(填a或b)侧先变红.②电解反应的化学方程式为
.
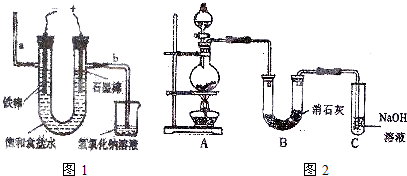
Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应的化学方程式
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
.
(2)漂白粉将在U形管中产生,其化学方程式是
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
.
(3)C装置的作用是
吸收未反应完的氯气,防止污染空气
吸收未反应完的氯气,防止污染空气
.
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.
①温度较高时氯气与消石灰反应成Ca(ClO
3)
2,为避免此副反应的发生,可采取的措施是
冷却B装置
冷却B装置
.
②试判断另一个副反应(用化学方程式表示)
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
.为避免此副反应的发生,可将装置作何改进
在A、B之间接一个装有饱和的NaCl溶液的洗气瓶
在A、B之间接一个装有饱和的NaCl溶液的洗气瓶
.