
题目列表(包括答案和解析)
 选考题[化学--选修化学与生活]
选考题[化学--选修化学与生活]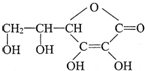 ,它的分子式是
,它的分子式是A、B、C、D1、D2、E、F、G、H均为有机化合物,请根据下列图示回答问题。
(1)直链有机化合物A的结构简式是 ;
(2)①的反应试剂和反应条件是 ;
(3)③的反应类型是 ;
(4)B生成C的化学方程式是 ;
D1或D2生成E的化学方程式是 。
(5)G可应用于医疗、爆破等,由F生成G的化学方程式是:
。
石油裂化的主要目的是为了
A.提高轻质液体燃料的产量
B.便于分馏
C.获得短链不饱和气态烃
D.提高汽油的质量
《化学与技术》模块(选考题)
29.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com