
题目列表(包括答案和解析)
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·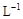 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①产物中的单质B是__________________。
(2)②中所发生的各反应的化学方程式是________________________________,_________________________________________________________。
(3)③中所发生的各反应的离子方程式是________________________________,_________________________________________________________。
(4)NaClO是一种很强的氧化剂,请写出酸性环境中NaClO将Fe2+氧化的离子方程式_________________________________________________________。
(5)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为___________________,c(Fe2+)为____________________。
已知BiCl3可与水反应生成BiOCl沉淀.试回答下列问题:
(1)写出BiCl3与水反应的化学方程式:
______________________________________________________________________________.
(2)医药上把BiOCl叫次氯酸铋,从化学命名的角度看,该名称是________(填“正确的”或“不正确的”),理由是_________________________________________________________.
(3)铋酸钠(NaBiO3)在酸性介质中可将Mn2+氧化成 ,在调节NaBiO3溶液为酸性时,不能选用的酸是
,在调节NaBiO3溶液为酸性时,不能选用的酸是
[ ]
|
A.稀H2SO4 |
B.稀HCl |
|
C.稀HNO3 |
D.亚硫酸 |
在酸性条件下,KBrO3能把KI氧化成I2或KIO3,本身被还原成为Br![]() 或Br2。KIO3能氧化KI生成I2氧化Br
或Br2。KIO3能氧化KI生成I2氧化Br![]() 成为Br2。(自己均被还原成I2)。请写出硫酸介质中KBrO3与KI发生反应的三个离子方程式:
成为Br2。(自己均被还原成I2)。请写出硫酸介质中KBrO3与KI发生反应的三个离子方程式:
(1)① ,
② ,
③ 。
(2)现取1.0L 4mol/L KBrO3溶液和4.0L 10mol/L KI溶液与足量的稀H2SO4混合你认为可以发生上述三个反应的哪些反应?
(3)计算(2)中含卤素的氧化产物与还原产物的物质的量之比。
在酸性条件下,KBrO3能把KI氧化成I2或KIO3,自身被还原成为Br-或Br2;KIO3能把KI氧化成I2,或把Br-氧化成Br2;自身则被还原为I2.
(1)请写出硫酸介质中KBrO3与KI发生反应的3个化学方程式:
①________________
②________________
③________________
(2)现取1.0L 0.4mol/L KBrO3和4.0L 0.10mol/L KI与足量的稀H2SO4混合,你认为可以发生上3个反应的哪些反应(填编号)________
(3)计算(2)中含卤素的氧化产物与还原产物的物质的量之比________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com