
题目列表(包括答案和解析)
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最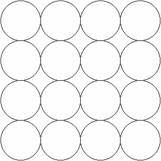 密堆积形式Ax 。如右图所示为Ax 堆积的片层形式,然后第二层就堆积在第一层的空隙上。请根据Ax 的堆积形式回答:
密堆积形式Ax 。如右图所示为Ax 堆积的片层形式,然后第二层就堆积在第一层的空隙上。请根据Ax 的堆积形式回答:
(1)计算在片层结构中(如右图所示)球数、空隙数和切点数之比
(2)在Ax 堆积中将会形成正八面体空隙和正四面体空隙。请在片层图中画出正八面体空隙(用?表示)和正四面体空隙(用×表示)的投影,并确定球数、正八面体空隙数和正四面体空隙数之比
(3)指出Ax 堆积中小球的配位数
(4)计算Ax 堆积的原子空间利用率。
(5)计算正八面体和正四面体空隙半径(可填充小球的最大半径,设等径小球的半径为r)。
(6)已知金属Ni晶体结构为Ax 堆积形式,Ni原子半径为124.6 pm,计算金属Ni的密度。(Ni的相对原子质量为58.70)
(7)如果CuH 晶体中Cu+的堆积形式为Ax 型,H- 填充在空隙中,且配位数是4。则H- 填充的是哪一类空隙,占有率是多少?
(8)当该同学将这种Ax 堆积形式告诉老师时,老师说Ax 就是A1或A3的某一种。你认为是哪一种,为什么?
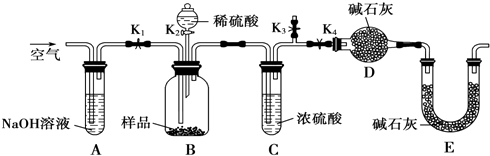
 过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
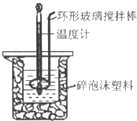 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: 3Y+Z
3Y+Z 3Y+Z
3Y+Z| 0.6 |
| t1 |
| 0.6 |
| t1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com