Ⅰ.配平下列反应方程式:
NaIO
3+
NaHSO
3--
I
2+
Na
2SO
4+
H
2SO
4+
H
2O
Ⅱ.废旧金属的回收再利用是保护自然资源的有力措施.一批成分不详的合金废料,为了确定其成分和再利用途径,探究性学习小组拟定以下方案进行实验分析:
请回答下列问题:
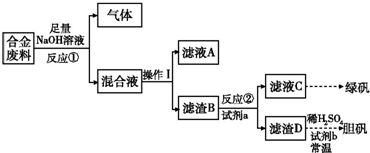
(1)从上述信息知,该合金中可确定的成分有
;(填化学式)
(2)滤渣D中加入稀硫酸和试剂b,常温下可制得胆矾,是一种绿色化学工艺,则试剂b是
;写出总反应方程式
;
(3)甲、乙两同学都验证了反应①生成气体是氢气,甲同学推断滤液A应是NaAlO
2;乙同学查阅资料得知硅与NaOH溶液反应也有H
2放出,因此持不同意见,请你设计一最佳方案,帮助他们作一确证:(写出选用试剂、实验判断现象及得出结论)
(4)取质量均为m g的滤渣B四份,分别加入同浓度,不同体积的稀HNO
3充分反应,在标准状况生成NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 |
1 |
2 |
3 |
4 |
| 稀HNO3体积(mL) |
100 |
200 |
300 |
400 |
| 剩余金属质量(g) |
9.0 |
4.8 |
0 |
0 |
| NO体积(L) |
1.12 |
2.24 |
3.36 |
V |
①实验1溶解的金属是
;质量为
g;
②写出实验4中金属恰好溶解后,发生反应的离子方程式:
.实验4中V的数值为
.



