(2011?烟台模拟)铬抗腐蚀性高,在钢中含量达到12%称为不锈钢.工业上冶炼铬的主要步骤如图所示:
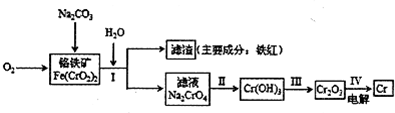
试回答下列问题
(1)已如步骤Ⅱ的反应方程式为:
8Na
2CrO
4+6Na
2S+23H
2O→8Cr(OH)
3↓十3Na
2S
2O
3十22NaOH
该反应中氧化剂是
Na2CrO4
Na2CrO4
(填化学式),生成 lmolCr(OH)
3时转移电子的物质的量为
3
3
mol.
(2)步骤IV中电解Cr
2O
3的阳极反应式为
2O2--4e-═O2↑
2O2--4e-═O2↑
,此时Cr
2O
3?的状态为
液态(或熔融态)
液态(或熔融态)
.
(3)常温下,铬能慢慢溶于稀盐酸、稀硫酸,但不溶于浓硝酸.其不溶于浓硝酸的原因可能是
表面生成致密氧化膜(或发生钝化)
表面生成致密氧化膜(或发生钝化)
.
(4)已如:2CrO
42-+2H
+
Cr
2O
72-+H
2O
①25.C,K
SP(Ag
2Cr
2O
4)=1.12×10
-12,K
SP(Ag
2Cr
2O
7)=2×10
-7,往Na
2Cr
2O
7溶液中加入AgNO
3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是
Ag2CrO4
Ag2CrO4
.
②将wg固体Na
2CrO
4溶于适量水配成lL溶液,该溶液中有关粒子的浓度(mol?L
-1)与pH的关系如下表:

由上表可知:
Ⅰ.要使溶液中CrO
42-的量达到最大,应控制溶液的pH
>9
>9
(用>、<、=及相关数据表示).
Ⅱ. w g固体Na
2CrO
4的物质的量n=
n(CrO42-)+c(Cr2O72-)+n(HCrO4-)
n(CrO42-)+c(Cr2O72-)+n(HCrO4-)
(用数学表达式表示).


 Cr2O72-+H2O
Cr2O72-+H2O