
题目列表(包括答案和解析)
 2HCl↑+3Cl2↑+2Au,制得黄金并重新铸成金光灿烂的奖章。这表现出了伟大科学家的非凡智慧和对祖国的无比热爱。下列说法正确的是( )。
2HCl↑+3Cl2↑+2Au,制得黄金并重新铸成金光灿烂的奖章。这表现出了伟大科学家的非凡智慧和对祖国的无比热爱。下列说法正确的是( )。| A、石灰之所以可以杀灭H5N1亚型高致病性禽流感病毒,是由于石灰与水反应产生的氢氧化钙显强碱性,病毒为蛋白质,可以使蛋白质变性,而使病毒失去活性 | B、饱和石灰水中加入生石灰,在温度不变的情况下,pH不变 | C、饱和石灰水中加入生石灰,在温度不变的情况下,Ca2+的物质的量不变 | D、给饱和石灰水溶液升高温度,c(Ca2+)的浓度不变 |
下图为某实验者设计的验证银圆完全溶解于一定量的浓硝酸,生成的NO2气体中含有NO的实验装置图。
常温时,NO2与N2O4混合存在;在低于0 ℃时,几乎只有无色N2O4晶体存在。
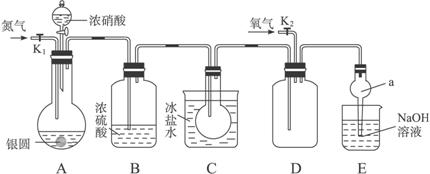
(1)反应前先打开A部分的活塞K1,持续通一段时间N2,其理由是_______________________
_____________________________________________________________________。
(2)若装置中缺B部分,其后果是_________________________________________________。
(3)反应结束后,打开D部分的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是_____________________________
_____________________________________________________________________。
(4)E部分中a仪器所起的作用是_________________________________________________。
(5)已知该银圆的质量为25 g,加入75 mL 12 mol·L-1的浓硝酸。实验结束后,A部分烧瓶内溶液中H+的浓度为2 mol·L-1(反应中HNO3既无挥发也无分解),体积仍为75 mL。
①参加反应的硝酸的物质的量为_________________________。
②为测定该银圆中铜的质量分数,还须进行的主要实验操作是_________________________。
下图为某实验者设计的验证银圆完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0 ℃时,几乎只有无色的N2O4晶体存在。
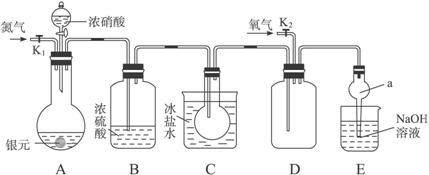
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是______________________。
(2)若装置中缺B,其后果是____________________________________________________。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是____________________________。
(4)C装置的作用是______________________;E中a仪器所起的作用是________________。
(5)已知该银圆的质量为25 g,加入75 mL 12 mol·L-1的浓硝酸。实验结束后,A中烧瓶内溶液中H+的浓度为2 mol·L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75 mL。
①参加反应的硝酸的物质的量是_________________。
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是__________________________。
(1)偏二甲肼的分子中有一个氮原子是以—N—形式存在,该氮原子不与氢原子直接相连,则偏二甲肼的结构简式为____________________;偏二甲肼的同分异构体有多种,请任意写出其中两种的结构简式________________________________________。
(2)对偏二甲肼结构和性质的推测正确的有____________。
A.偏二甲肼属于无机化合物
B.固态时是分子晶体
C.偏二甲肼分子中含有离子键
D.分子中的所有N原子和C原子都在同一平面上
(3)偏二甲肼作为火箭燃料燃烧时,以N2O4为氧化剂,燃烧产物只有N2、CO2和H2O。这一反应的化学方程式为____________________________________________________。
(4)肼(N2H4)也是一种常用的火箭燃料,对应的氧化剂,通常用过氧化氢。1 g液态的肼与足量的过氧化氢反应时放出25.6 kJ的热量(通常状况测定)。肼和过氧化氢反应的热化学方程式是____________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com