
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡. | 有白色沉淀产生. | 说明原溶液中一定含有 Na2CO3 Na2CO3 . |
| (2)取(1)试管中的上层清液滴加酚酞试液. | 溶液变红色. | 则溶液中一定含有 NaOH NaOH . |
 化学兴趣小组的同学对碳及碳的氧化物进行了一系列拓展性探究学习.
化学兴趣小组的同学对碳及碳的氧化物进行了一系列拓展性探究学习.
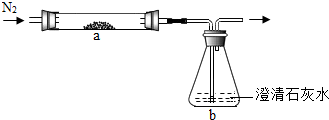

某化学兴趣小组的同学在课外读物中看到:“通常CO2可做灭火剂,但有些物质(如Na)着火,不能用CO2熄灭。”他们决定探究CO2与 Na反应的产物。
⑴提出猜想:CO2与 Na反应可能生成四种物质:C、CO、Na2O、Na2CO3。
⑵查阅资料:
①Na是非常活泼的金属,在常温下能与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应;
③Na2O是白色固体,与H2O反应生成NaOH;
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。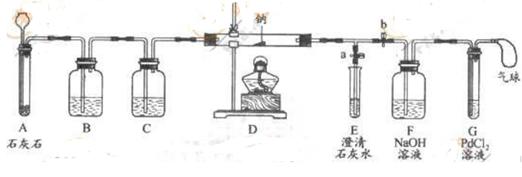
⑶实验过程:同学们在老师的指导下设计了如图所示的装置(夹持仪器已略去)
①实验记录:
| 序号 | 实验操作 | 主要实验现象 | 试验结论及解释 |
| Ⅰ | 打开a,关闭b,由长颈漏斗向A中注入稀盐酸 | A中产生大量气泡,E中出现浑浊 | E中反应的化学方程式为 |
| Ⅱ | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中的Na剧烈燃烧,产生白烟,内壁附有黑色、白色固体;G中产生黑色沉淀 | 反应的产物中一定有 和 |
| Ⅲ | 将D中白色固体加入试管中,加水溶解,再加入澄清石灰水 | 产生白色沉淀 | 反应的产物中还有 |
某化学兴趣小组的同学在课外读物中看到:“通常CO2可做灭火剂,但有些物质(如Na)着火,不能用CO2熄灭 。”他们决定探究CO2与 Na反应的产物。
⑴提出猜想:CO2与 Na反应可能生成四种物质:C、CO、Na2O、Na2CO3。
⑵查阅资料:
①Na是非常活泼的金属,在常温下能与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应;
③Na2O是白色固体,与H2O反应生成NaOH;
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。

⑶实验过程:同学们在老师的指导下设计了如图所示的装置(夹持仪器已略去)
①实验记录:
|
序号 |
实验操作 |
主要实验现象 |
试验结论及解释 |
|
Ⅰ |
打开a,关闭b,由长颈漏斗向A中注入稀盐酸 |
A中产生大量气泡,E中出现浑浊 |
E中反应的化学方程式为
|
|
Ⅱ |
当E中出现浑浊时,打开b,关闭a,点燃酒精灯 |
D中的Na剧烈燃烧,产生白烟,内壁附有黑色、白色固体;G中产生黑色沉淀 |
反应的产物中一定有 和 |
|
Ⅲ |
将D中白色固体加入试管中,加水溶解,再加入澄清石灰水 |
产生白色沉淀 |
反应的产物中还有
|
②实验反思:
Ⅰ.实验记录Ⅱ中, E中出现浑浊后埔再点燃酒精灯的目的是
Ⅱ.若无装置C,对实验有影响的物质是 。
Ⅲ.检验第四种物质是否存在的实验方案:将D中白色固体加入试管中,
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com