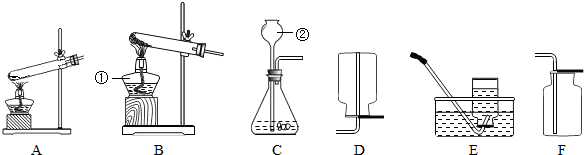
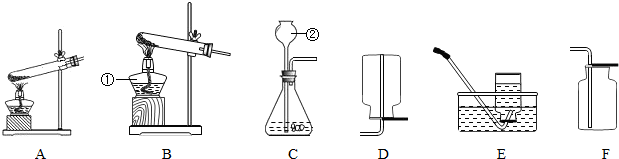
某铁矿石的主要成分是Fe
2O
3,是冶炼金属铁的原料.某兴趣小组想测定该铁矿石中铁的含量,利用氢气来还原Fe
2O
3,设计了如下实验方案(注:铁矿石中的杂质在高温下不分解,也不参加反应).

(1)如果用锌粒与浓盐酸来制取氢气,可以选择图(一)
(填序号)发生装置;装置②的主要仪器有分液漏斗、带导管的双孔胶塞和
(填仪器名称).
(2)制得的氢气常含有少量水蒸气和HCl气体,若要得到干燥、纯净的氢气,需要通过④和⑤装置,则装置按导管字母连接的顺序是:发生装置→
→
→
→
→收集装置.

(3)若要检验氢气中的杂质HCl,可把
装置.中的试剂换成
,实验中观察到的现象是试剂变成了红色.
(4)图(一)中的③装置是一个用排空气法收集氢气的装置,由集气瓶和导管组成,请你在方框内画出该装置.
(5)图(二)是氢气与铁矿石样品反应的装置,在加热反应之前要先通入一段时间的氢气,原因是
;而在反应结束时先要停止加热,一段时间后再停止通入氢气,原因是
.

(6)已知参加反应的铁矿石样品的质量为m
1g,完全反应后剩余固体质量为m
2g,装置⑦增加的质量为m
3g,装置⑧增加的质量为m
4g.(假设每一步都进行完全)若要计算铁矿石样品中Fe
2O
3的质量分数,下面可计算到结果的数据组合有
.(填字母)
Am
1g与m
2g B、m
1g与m
3g C、m
1g与m
4g D、m
2g与m
4g.