
题目列表(包括答案和解析)
32.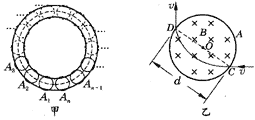 正负电子对撞机的最后部分的简化示意图如图甲所示(俯视图),位于水平面内的粗实线所示的圆环形真空管道是正、负电子做圆运动的“容器”,经过加速器加速后的正、负电子被分别引入该管道时,具有相等的速率v,它们沿着管道向相反的方向运动.在管道内控制它们转弯的是一系列圆形电磁铁,即图中的A1、A2、A3……An共有n个,均匀分布在整个圆环上,每个电磁铁内的磁场都是磁感应强度相同的匀强磁场,并且方向竖直向下,磁场区域的直径为d,改变电磁铁内电流的大小,就可改变磁场的磁感应强度,从而改变电子偏转的角度.经过精确的调整,首先实现电子在环形管道中沿图甲中粗虚线所示的轨迹运动,这时电子经过每个电磁场区域时射入点和射出点都是电磁场区域的同一条直径的两端,如图所示.这就为进一步实现正、负电子的对撞作好了准备.
正负电子对撞机的最后部分的简化示意图如图甲所示(俯视图),位于水平面内的粗实线所示的圆环形真空管道是正、负电子做圆运动的“容器”,经过加速器加速后的正、负电子被分别引入该管道时,具有相等的速率v,它们沿着管道向相反的方向运动.在管道内控制它们转弯的是一系列圆形电磁铁,即图中的A1、A2、A3……An共有n个,均匀分布在整个圆环上,每个电磁铁内的磁场都是磁感应强度相同的匀强磁场,并且方向竖直向下,磁场区域的直径为d,改变电磁铁内电流的大小,就可改变磁场的磁感应强度,从而改变电子偏转的角度.经过精确的调整,首先实现电子在环形管道中沿图甲中粗虚线所示的轨迹运动,这时电子经过每个电磁场区域时射入点和射出点都是电磁场区域的同一条直径的两端,如图所示.这就为进一步实现正、负电子的对撞作好了准备.
(1) 试确定正、负电子在管道内各是沿什么方向旋转的;
(2)已知正、负电子的质量都是m,所带电荷都是元电荷e,重力可不计,求电磁铁
内匀强磁场的磁感应强度B的大小.
31.Ⅰ.现有氧化铜和炭粉的混合物a mol,将它在隔绝空气的条件下加热。反应完毕后,
冷却,得残留固体。
(1)写出可能发生反应的化学方程式。
(2)若氧化铜在混合物中物质的量的比值为x (0<x<1),问:x为何值时,残留固体为
何种物质?写出残留固体的物质的量与x值之间的关系,将结果填入下表:
|
x值 |
残留固体 |
|
化学式 |
物质的量/mol |
|
|
|
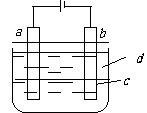
30.Ⅰ.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐
溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用右
图电解实验可制得白色纯净的Fe(OH)2,两电极的材料
分别为石墨和铁。
(1)a电极的材料应为 ,电极反应式为: 。
(2)电解液C可能是(填编号)
A. 纯水 B. NaCl溶液 C. NaOH溶液 D. CuCl2溶液
(3)d为苯,其作用为 ,在加入苯之前对c应作何简
单处理 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)
A. 改用稀硫酸作电解液 B. 适当增大电源的电压
C. 适当减小两电极间距离 D. 适当降低电解液的温度
(5)若c用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另有一明显现象为 。
29.鸵鸟是当今世界上最大的鸟。有人说,如果鸵鸟能长出一副与身体大小成比例的翅膀,就能飞起来。是不是这样呢?生物学统计的结论得出:飞翔的必要条件是空气的上举力F至少与体重G=mg平衡。鸟煽动翅膀,获得上举力的大小可以表示为F=cSv2,式中S为翅膀展开后的面积,v为鸟的飞行速度,而c是一个比例常数。我们作一个简单的几何相似形假设:设鸟的几何线度为L,那么其质量m∝L3,而翅膀面积S∝L2,已知小燕子的最小飞行速度是5.5m/s,鸵鸟的最大奔跑速度为11.5m/s,又测得鸵鸟的体长是小燕子的25倍,那么鸵鸟真的长出一副与身体大小成比例的翅膀后能飞起来吗?
28.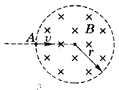 如图所示,在内部半径为r的绝缘圆筒中,有平行于圆筒轴线方向的匀强磁场,筒内为真空环境.一个质量为m,带电量为+q的粒子,自筒壁A处的小孔以速度v沿筒的半径方向垂直于磁场射入筒中.粒子在筒内空间运动时只受洛仑兹力作用,而且粒子在与筒壁碰撞时,无机械能损失并保持原有的电量,如果粒子在与筒壁相继碰撞若干次,运行一周后恰好仍从A孔射出,筒中磁感应强度B必须满足什么条件?所需相应的时间t是多少?推导出B和t的表达式
如图所示,在内部半径为r的绝缘圆筒中,有平行于圆筒轴线方向的匀强磁场,筒内为真空环境.一个质量为m,带电量为+q的粒子,自筒壁A处的小孔以速度v沿筒的半径方向垂直于磁场射入筒中.粒子在筒内空间运动时只受洛仑兹力作用,而且粒子在与筒壁碰撞时,无机械能损失并保持原有的电量,如果粒子在与筒壁相继碰撞若干次,运行一周后恰好仍从A孔射出,筒中磁感应强度B必须满足什么条件?所需相应的时间t是多少?推导出B和t的表达式
27. 实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2
和Ca(OH)2反应制漂白粉的反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=
Ca(ClO3)2 +5CaCl2+6H2O。现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,
可使气体顺利通过):
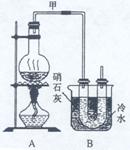
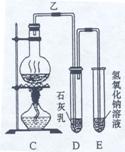
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序
号填于下表内。
a. 不易控制反应速率 b. 容易控制反应速率 c. 有副反应发生
d. 可防止副反应发生 e. 容易污染环境 f. 可防止污染环境
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)请从甲、乙、丙三装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右方向)为 ,在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,说明原因 。
26.

 已知CH3―CH―COOR CH 2
=C―COOR,RCH=CH2
R-CHCHO
已知CH3―CH―COOR CH 2
=C―COOR,RCH=CH2
R-CHCHO
(相对分子质量:R+27)(相对分子质量:R+57)
现有只含C、H、O的化合物A、F,有关它们的某些信息如下:

|
|
|
|
|

|

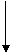
|
|
(1) 写出化合物A、E、F的结构简式:
A: E: F:
(2)写出B与足量的新制Cu(OH)2悬浊液反应的化学方程式: 。
25. 如下图所示的反应关系
|
|
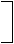
 高温
高温

|
|
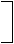
 高温
高温

|
|

 反应③
反应③
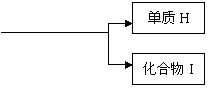 |
|||
|
|||
已知:①单质E可作半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:(1)化合物F的化学式是 ;
(2)化合物I的化学式是 ;
(3)反应③的化学方程式是 ;
(4)反应④的化学方程式是 。


|
|
24.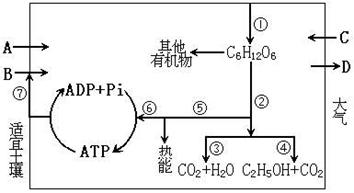 下图是绿色植物代谢的部分过程的示意图,请回答:
下图是绿色植物代谢的部分过程的示意图,请回答:
(1)图中A、B、C、D分别表示的物质是A________,B_______,C_______,D______。
(2)图中尚未表示出的使①正常进行的生态因素还有________和________。
(3)正常情况下与矿质元素的吸收关系最密切的生理过程是________呼吸,其物质代
谢的编号是________。
(4)从图中可以看出绿色植物的能量代谢包括(按顺序写出编号) ___________等变化。
其中属于能量转移的编号是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com