
题目列表(包括答案和解析)
29.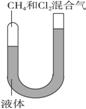 (12分))如下图所示,一端封闭的U形管,封闭的一端有CH4和Cl2的混合气体,U形管中的液体不参与反应,也不溶解反应物和生成物。使CH4和Cl2的混合气体(体积比1∶3充入)在可见光照射下缓慢反应一段时间。
(12分))如下图所示,一端封闭的U形管,封闭的一端有CH4和Cl2的混合气体,U形管中的液体不参与反应,也不溶解反应物和生成物。使CH4和Cl2的混合气体(体积比1∶3充入)在可见光照射下缓慢反应一段时间。
(1)写出甲烷与氯气反应的化学方程式(只写1个即可):___________。
(2)反应数小时后,U形管右侧(开放端)液体的液柱高度将( )
A.升高 B.下降 C.不变 D.难以确定
(3)对(2)的结论作一简要分析。
28. (12分)由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
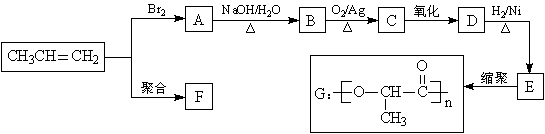
(1)聚合物F的结构简式是_____________________________________。
(2)D的结构简式是___________________________________________。
(3)B转化为C的化学方程式是__________________________________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是____________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属
钠反应产生1mol H2,则该种同分异构体为____________________________。
27.(18分) 下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
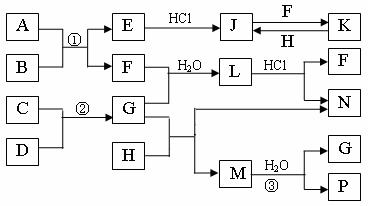
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 。
(2)F的化学式 ;G的水溶液中,最多的阳离子是 。
(3)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
26.(18分) 测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,可以准确求出原溶液中I-的浓度。主要步骤如是:
①取100mL样品溶液,用单质溴将样品中的I-氧化成IO ,将过量的溴除去。
,将过量的溴除去。
②再加入过量的KI,并用硫酸酸化,使IO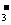 完全转化成I2。
完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-。
④将生成的I-萃取到水层后,用步骤①的方法再处理转化为IO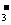 。
。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化,使IO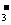 完全转化成I2。
完全转化成I2。
⑥将⑤得到的溶液完全转入250mL容量瓶,并加水稀释至刻度。
⑦分别取⑥得到的溶液25.00mL于锥形瓶中,加入指示剂,用0.1010mol/L 的Na2S2O3标准溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI)。
⑧重复操作⑦两次。
根据上述步骤回答下列问题:
(1)在操作①中,除去过量溴单质的方法是 。
(2)请写出操作②中发生的反应的离子方程式 。
(3)在萃取操作中,使用的玻璃仪器有 。步骤⑦使用的指示剂是 ;判断滴定达到终点的现象为 。
(4)下表是该实验的记录结果:
|
滴定 次数 |
待测溶液的体积 |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.05 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.11 |
20.09 |
原溶液中I-的物质的量浓度为 。
25、如图12所示,在一个圆形区域内,两个方向相反且都垂直于纸面的匀强磁场分布在以直径A2A4为边界的两个半圆形区域Ⅰ、Ⅱ中,A2A4与A1A3的夹角为60º。一质量为m、带电量为+q的粒子以某一速度从Ⅰ区的边缘点A1处沿与A1A3成30º角的方向射入磁场,随后该粒子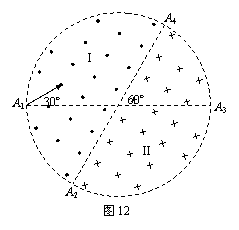 以垂直于A2A4的方向经过圆心O进入Ⅱ区,最后再从A4处射出磁场。已知该粒子从射入到射出磁场所用的时间为t,求Ⅰ区和Ⅱ区中磁感应强度的大小(忽略粒子重力)。
以垂直于A2A4的方向经过圆心O进入Ⅱ区,最后再从A4处射出磁场。已知该粒子从射入到射出磁场所用的时间为t,求Ⅰ区和Ⅱ区中磁感应强度的大小(忽略粒子重力)。
24.如图所示,矩形导线框abcd固定在水平面上,ab=L、bc=2L,整个线框处于竖直方向的磁感应强度为B的匀强磁场中。导线框上ab、cd段电阻不计,bc、ad段单位长度上的电阻为λ。今在导线框上放置一个与ab边平行且与导线框接触良好的金属棒MN,其电阻为r(r<λL)。金属棒在外力作用下沿x轴正方向做速度为v的匀速运动,在金属棒从导线框最左端(x=0)运动到最右端的过程中:
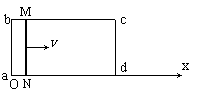 ⑴请导出金属棒中的感应电流I随x变化的函数关系式;
⑴请导出金属棒中的感应电流I随x变化的函数关系式;
⑵通过分析说明金属棒在运动过程中,MN两点间电压有最大值,并求出最大值Um;
⑶金属棒运动过程中,在什么位置MN的输出功率最大?并求出最大输出功率Pm。
23.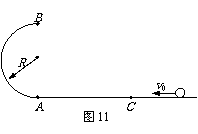 (12分)如图11所示,半径R=0.40m的光滑半圆环轨道处于竖直平面内,半圆环与粗糙的水平地面相切于圆环的端点A。一质量m=0.10kg的小球,以初速度v0=7.0m/s在水平地面上向左作加速度a=3.0m/s2的匀减速直线运动,运动4.0m后,冲上竖直半圆环,最后小球落在C点。求A、C间的距离(取重力加速度g=10m/s2)。
(12分)如图11所示,半径R=0.40m的光滑半圆环轨道处于竖直平面内,半圆环与粗糙的水平地面相切于圆环的端点A。一质量m=0.10kg的小球,以初速度v0=7.0m/s在水平地面上向左作加速度a=3.0m/s2的匀减速直线运动,运动4.0m后,冲上竖直半圆环,最后小球落在C点。求A、C间的距离(取重力加速度g=10m/s2)。
22.某同学按下图所示电路进行实验,实验时该同学把变阻器的触片P移到不同位置时测得各电表的示数如下表所示,将电压表内阻看作无限大,电流表内阻看作零.
|
序 号 |
A1示数(A) |
A2示数(A) |
V1示数(V) |
V2示数(V) |
|
1 |
0.62 |
0.30 |
2.41 |
1.21 |
|
2 |
0.45 |
0.32 |
2.55 |
0.49 |
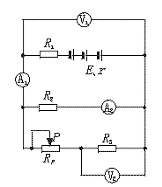 (1)电路中E、r分别为电源的电动势和内阻,R1、R2、R3为定值电阻,在这五个物理量中,可根据上表中的数据求得的物理量是(不要求具体计算)
;
(1)电路中E、r分别为电源的电动势和内阻,R1、R2、R3为定值电阻,在这五个物理量中,可根据上表中的数据求得的物理量是(不要求具体计算)
;
(2)由于电路发生故障,发现两电压表的示数相同(但不为零),若这种情况的发生是由电阻故障引起的,则可能的故障原因是 .
(3) 如图7所示,某同学在做“研究匀变速直线运动”实验中,由打点计时器得到表示小车运动过程的一条清晰纸带,纸带上两相邻计数点的时间间隔为T=0.10s,其中S1=7.05cm、S2=7.68cm、S3=8.33cm、S4=8.95cm、S5=9.61cm、S6=10.26cm,则A点处瞬时速度的大小是_______m/s,小车运动的加速度计算表达式为_______,加速度的大小是_______m/s2(计算结果保留两位有效数字)。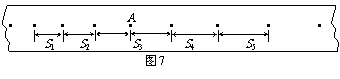

21.在金属中存在大量的价电子(可理解为原子的最外层电子),价电子在原子核和核外的其他电子产生的电场中运动.电子在金属外部时的电势能比它在金属内部作为价电子时的电势能大,前后两者的电势能差值称为势垒,用符号 V 表示.价电子就像被关在深为 V 的方箱里的粒子,这个方箱叫做势阱,价电子在势阱内运动具有动能,但动能的取值是不连续的,价电子处于最高能级时的动能称为费米能,用
Ef表示.用红宝石激光器向金属发射频率为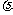 的光子,具有费米能的电子如果吸收了一个频率为
的光子,具有费米能的电子如果吸收了一个频率为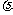 的光子而跳出势阱,则
的光子而跳出势阱,则
A .具有费米能的电子跳出势阱时的动能 EK=h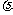 -V + Ef
-V + Ef
B .具有费米能的电子跳出势阱时的动能EK=h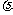 -V-Ef
-V-Ef
C .若增大激光器的发光强度,具有费米能的电子跳出势阱时的动能增大
D .若增大激光器的发光强度,具有费米能的电子跳出势阱时的动能不变
第II卷
20. 如图所示,闭合金属导线框放置在竖直向上的匀强磁场中,匀强磁场的磁感应强度的大小随时间变化.下列说法
如图所示,闭合金属导线框放置在竖直向上的匀强磁场中,匀强磁场的磁感应强度的大小随时间变化.下列说法
A.当磁感应强度增加时,线框中的感应电流可能减小
B.当磁感应强度增加时,线框中的感应电流一定增大
C.当磁感应强度减小时,线框中的感应电流一定增大
D.当磁感应强度减小时,线框中的感应电流可能不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com