
题目列表(包括答案和解析)
1、
 (2008年山东烟台)正确的化学实验操作对实验结果、人身安全都非常重要。在下图所示实验操作中,正确的是
(2008年山东烟台)正确的化学实验操作对实验结果、人身安全都非常重要。在下图所示实验操作中,正确的是

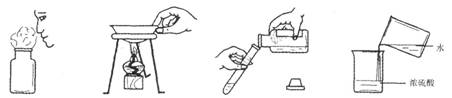

 (A)闻气体气味 (B)移走蒸发皿 (C)倾倒液体 (D)稀释浓硫酸
(A)闻气体气味 (B)移走蒸发皿 (C)倾倒液体 (D)稀释浓硫酸
2.

 (09福建晋江)二氧化硫工业上可用于生产硫酸,化学方程式为2SO2
+ O2 + 2H2O = 2H2SO4。现有32吨SO2气体,欲使它完全转化为硫酸,至少应通入氧气多少吨?
(09福建晋江)二氧化硫工业上可用于生产硫酸,化学方程式为2SO2
+ O2 + 2H2O = 2H2SO4。现有32吨SO2气体,欲使它完全转化为硫酸,至少应通入氧气多少吨?


 关键词:根据化学方程式的计算
关键词:根据化学方程式的计算


 答案:解:设至少应通入氧气的质量为x
答案:解:设至少应通入氧气的质量为x


 2SO2 + O2 + 2H2O = 2H2SO4
2SO2 + O2 + 2H2O = 2H2SO4


 128 32
128 32


 32t x
32t x


 128∶32 = 32t∶x
128∶32 = 32t∶x


 x = 8t
x = 8t


 答:至少应通入氧气8t。
答:至少应通入氧气8t。







1.

 (09福建南平)某厂生产的产品碳酸钠中混有少量碳酸氢钠。为了测定产品中碳酸钠的质量分数,取100g样品加热(2NaHCO3
(09福建南平)某厂生产的产品碳酸钠中混有少量碳酸氢钠。为了测定产品中碳酸钠的质量分数,取100g样品加热(2NaHCO3  Na2CO3
+ H2O + CO2↑ ,碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g。求:
Na2CO3
+ H2O + CO2↑ ,碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g。求:


 (1)样品中碳酸氢钠的质量。
(1)样品中碳酸氢钠的质量。


 (2)样品中碳酸钠的质量分数。
(2)样品中碳酸钠的质量分数。


 关键词:化学方程式计算的应用
关键词:化学方程式计算的应用


 答案:(1)解:设样品中碳酸氢钠的质量为X
答案:(1)解:设样品中碳酸氢钠的质量为X


 2NaHCO3
2NaHCO3  Na2CO3
+ H2O + CO2↑
Na2CO3
+ H2O + CO2↑


 1 68
44
1 68
44


 X
0.22g
X
0.22g



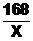 ==
== 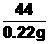





 X == 0.84g
X == 0.84g


 (2)碳酸钠的质量分数 ==
(2)碳酸钠的质量分数 == 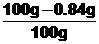 ×100%
== 99.16%
×100%
== 99.16%


 答:样品中碳酸氢钠的质量是0.84g;碳酸钠的质量分数是99.16%。
答:样品中碳酸氢钠的质量是0.84g;碳酸钠的质量分数是99.16%。



5.

 (09广东省佛山市)用纯净的木炭粉末还原氧化铜粉末时,可发生的反应有:C + 2CuO=2Cu + CO2↑,C + CuO=Cu + CO↑。现用1.2g木炭粉末还原10g氧化铜粉末,反应物刚好反应完全,则生成的气体产物是( )
(09广东省佛山市)用纯净的木炭粉末还原氧化铜粉末时,可发生的反应有:C + 2CuO=2Cu + CO2↑,C + CuO=Cu + CO↑。现用1.2g木炭粉末还原10g氧化铜粉末,反应物刚好反应完全,则生成的气体产物是( )


 A.CO2
B.CO
C.CO、CO2 D.Cu、CO
A.CO2
B.CO
C.CO、CO2 D.Cu、CO


 答案:C
答案:C
4.


 (2009南京)某固体样品中除了含有在高温下不分解,也不与空气成分反应的物质外,还可能含有 CaCO3 、CaO中的一种或两种。某化学兴趣小组为探究该固体的成分,称量样品m1 g,经高温充分煅烧并在干燥的保护气中冷却,至质量不再减轻为止,剩余固体的质量为m2 g。下列推断不正确的是 ( )
(2009南京)某固体样品中除了含有在高温下不分解,也不与空气成分反应的物质外,还可能含有 CaCO3 、CaO中的一种或两种。某化学兴趣小组为探究该固体的成分,称量样品m1 g,经高温充分煅烧并在干燥的保护气中冷却,至质量不再减轻为止,剩余固体的质量为m2 g。下列推断不正确的是 ( )


 A、若m1=m2,则原样品中无CaCO3 B、若m2<m1,则原样品中一定有CaCO3
A、若m1=m2,则原样品中无CaCO3 B、若m2<m1,则原样品中一定有CaCO3


 C、若56m1/100<m2<m1,则原样品中一定有CaO
C、若56m1/100<m2<m1,则原样品中一定有CaO


 D、若56m1/100<m2<m1,则原样品中一定无CaO
D、若56m1/100<m2<m1,则原样品中一定无CaO


 思路分析:高温灼烧碳酸钙会分解生成氧化钙和二氧化碳,从而导致固体质量减少,则固体质量只要变化则说明有碳酸钙存在;但固体样品中含有高温下加热不分解的物质,则无法对固体中是否含有氧化钙进行分析。
思路分析:高温灼烧碳酸钙会分解生成氧化钙和二氧化碳,从而导致固体质量减少,则固体质量只要变化则说明有碳酸钙存在;但固体样品中含有高温下加热不分解的物质,则无法对固体中是否含有氧化钙进行分析。


 答案:CD
答案:CD



3.

 (09海南) W、X、Y、Z四种物质在一定条件下充分反应后,测得反应前后各物质的质量如下:
(09海南) W、X、Y、Z四种物质在一定条件下充分反应后,测得反应前后各物质的质量如下:
|
物质 |
W |
X |
Y |
Z |
|
反应前质量g |
2 |
22 |
34 |
0 |
|
反应后质量g |
2 |
40 |
待测 |
16 |
下列说法错误的是


 A.W在反应中可能是催化剂
B.该反应中生成X的质量为40g
A.W在反应中可能是催化剂
B.该反应中生成X的质量为40g


 C.该反应属于分解反应
D.该反应中Y全部参加反应
C.该反应属于分解反应
D.该反应中Y全部参加反应



 [解答]B
[解答]B
2.

 (09无锡)一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示下列叙述正确的是
(09无锡)一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示下列叙述正确的是
|
物质 |
A |
B |
C |
D |
|
第一次测得的质量/g |
50 |
4 |
4.6 |
1 |
|
第二次测得的质量/g |
待测 |
20 |
23 |
4.2 |
A.上述反应属于化合反应 B.该反应应C与D的质量变化之比为23:4


 C.第二次测得A的质量为12.4g D.该反应中共生成D的质量为4.2g
C.第二次测得A的质量为12.4g D.该反应中共生成D的质量为4.2g



 答案:BC
答案:BC



1.

 (09广西贺州)在托盘天平的左、右两盘中各放一只烧杯,调节至平衡,向烧杯分别注入等质量、质量分数相同的稀硫酸,然后向两只烧杯中分别加入相同质量的铜铝合金和锌,待物质反应结束后,天平仍保持平衡,合金中铝与铜的质量比为(
)
(09广西贺州)在托盘天平的左、右两盘中各放一只烧杯,调节至平衡,向烧杯分别注入等质量、质量分数相同的稀硫酸,然后向两只烧杯中分别加入相同质量的铜铝合金和锌,待物质反应结束后,天平仍保持平衡,合金中铝与铜的质量比为(
)


 A、18∶47 B、54∶65 C、27∶64 D、27∶38
A、18∶47 B、54∶65 C、27∶64 D、27∶38


 答案:A
答案:A



6.

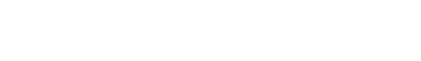 解:设最多生成单质镁的质量为x ,生成氯气的质量为y。
解:设最多生成单质镁的质量为x ,生成氯气的质量为y。


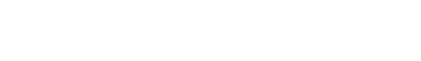 MgCl2 通电 Mg +
Cl2 ↑
MgCl2 通电 Mg +
Cl2 ↑


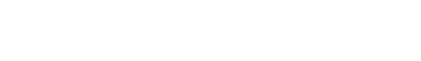 95
24
71
95
24
71


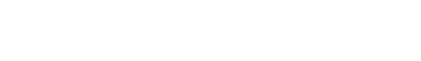 950Kg x y
950Kg x y


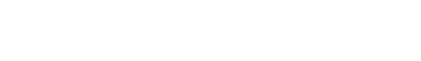 95:24=950Kg:x ; 95:71=950Kg:y;
95:24=950Kg:x ; 95:71=950Kg:y;


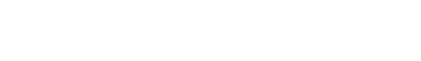 x=240Kg ;y=710kg
x=240Kg ;y=710kg





5.

 答案:设含硫400g的煤炭燃烧时产生二氧化硫的质量为X。
答案:设含硫400g的煤炭燃烧时产生二氧化硫的质量为X。


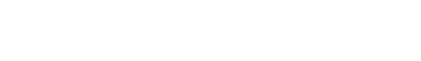 S + O2
S + O2  SO2
SO2


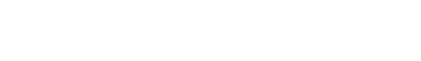 32
64
32
64


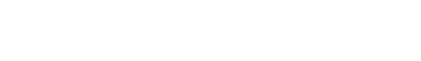 400g
X
400g
X


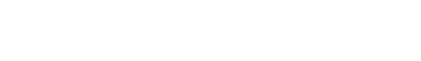
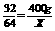 解得:X=800g 答:含硫400g的煤炭燃烧时产生二氧化硫的质量为800g。
解得:X=800g 答:含硫400g的煤炭燃烧时产生二氧化硫的质量为800g。


 解析:因为题目已知中已经告诉了硫的质量是400g,根据硫燃烧的方程式,可以直接求得生成二氧化硫的质量。
解析:因为题目已知中已经告诉了硫的质量是400g,根据硫燃烧的方程式,可以直接求得生成二氧化硫的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com