
题目列表(包括答案和解析)
26、①2SO42- ②3N2 ③ Fe ④CH3COOH
34、(6分)某纯碱样品中含有少量氯化钠。为测定样品中碳酸钠的质量分数,现称取该样品11g,加入到盛有50g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g。计算:
(1)完全反应后生成CO2的质量;
(2)纯碱样品中碳酸钠的质量分数(结果精确到0.1%)
|
33、(8分) 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如下图所示。要求同学们进行探究:确认这瓶溶液导电是什么溶液?
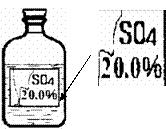

[提出猜想] 王老师提示:这瓶无色溶液只能是下了四种溶液中的一种:①硫酸镁溶液、②硫酸钠溶液、③硫酸溶液、④硫酸铵溶液
[查阅资料] (1)常温下,相关物质的溶解度如下:
|
物质 |
MgSO4 |
Na2SO4 |
(NH4)2SO4 |
H2SO4 |
|
溶解度 |
35.1g |
19.5g |
75.4g |
与水任意比互溶 |
(2)(NH4)2SO4的水溶液显酸性
[实验探究] (1)通过查阅资料,小明同学认为猜想 (填序号)不成立,原因是 。
(2)为确定其它几种猜想是否正确,小明同学继续进行探究:
|
实验操作 |
实验现象 |
实验结论 |
|
①取该溶液少许于试管中,向其中滴加几滴 溶液 |
溶液中有白色沉淀生成 |
猜想①成立 |
|
②用玻璃棒蘸取少许原溶液滴在pH试纸水,并跟比色卡对照 |
溶液pH小于7 |
猜想③成立 |
小雅同学认为小明实验操作②的结论不正确,她的理由是 ;
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
|
实验操作 |
实验现象 |
实验结论 |
|
取该溶液少许于试管中, |
|
猜想④成立,该反应的化学方程式为
|
29、(5分) 由C、H、O、Fe四种元素组成的初中常见物质间有如图所示的关系,其中A、B、C是单质,甲、乙是化合物。图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质。(部分反应物、生成物及反应条件略去)。回答下列问题:

(1) 写出下列物质的化学式:A 、C 、甲 ;
(2) 写出乙→B反应的化学方程式 。
28、(5分)下图是实验室常用的气体制备、收集、检验的多功能装置。
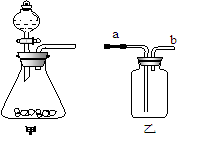
(1)图中甲装置常用于制取氧气,其反应的化学方程式是 ;利用甲装置还能制取 气体。
(2) 若在乙装置中盛满水,用排水法收集(瓶口向上)一瓶氧气,气体从 端(填字母“a”或“b”)通入。
(3) 某同学用排水法收集一瓶氧气,将带火星的木条伸入集气瓶中,木条不复燃,原因可能是 (答一条即可)。
27、(4分)今年我省遭遇50年一遇的严重干旱,旱灾地区的饮用水问题备受关注。漂白粉是旱灾地区应急饮用水常用的消毒剂,其主要成分是氯化钙(CaCl2)和次氯酸钙[Ca(ClO)2]。回答下列问题:
(1)为了缓解旱情,气象部门适时实施人工降雨,下列物质可用作人工降雨的是 (填序号)
A.干冰 B.CO2 C 冰 D水
(2)漂白粉属于 (填序号)
A. 化合物 B . 单质 C.纯净物 D。 混合物
(3)家用漂白粉的消毒原理是:漂白粉中的次氯酸钙[Ca(ClO)2]与水和空气中的CO2反应生成了次氯酸(HClO)和另一种物质,次氯酸具有杀菌消毒作用。试写出次氯酸钙[Ca(ClO)2]与水和CO2反应的化学方程式 。
26、(4分)用符号和数字填空
① 2个硫酸根离子 ;② 3个氮气分子 ;
③ +3价的铁元素 ;④ 厨房用的酸性调味品中的酸 。
34.(6分)实验室制取氧气所用的氯酸钾通常含一定量的杂质。小明同学称取6.00g样品与2.00g二氧化锰混合,加热使其完全反应,冷却至室温。将剩余固体与17.02g水充分溶解,过滤,得到的不饱和溶液中溶质的质量分数为14.9%。 若不考虑实验中药品的损耗,氯酸钾样品中的杂质不参与反应,也不溶于水。请回答下列问题。(结果精确到0.01g)
(1)要完全回收反应生成的氯化钾,还需进行的操作是________,可回收氯酸钾的质量为________;
(2)计算样品中氯酸钾的质量是多少?
(可能用到的相对原子质量:O-16Cl-35.
33.(6分)某无色溶液可能由盐酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成。为探究其组成,小华同学进行了如下实验:
Ⅰ、取适量样品放入试管中,滴加酚酞溶液,溶液变成红色。再向试管中逐滴加入过量的氢氧化钙溶液,观察到有沉淀产生。过滤,所得滤液为红色。
(1)由实验Ⅰ中的现象可推断出样品中一定含有的物质是________(写化学式,下同),一定不含有的物质是________;
为了进一步探究样品中可能含有的物质是否存在,小华继续进行了如下实验:
Ⅱ、取适量实验Ⅰ所得的红色滤液放入试管中,滴加过量的稀硝酸,溶液变无色。再向试管中逐滴加入适量的硝酸银溶液至恰好完全反应,观察到有白色沉淀生成。过滤,所得滤液为无色。
Ⅲ、从稀硫酸、氢氧化钡溶液、氯化钡溶液、硝酸钾溶液中选择一种试剂,代替实验Ⅰ中的氢氧化钙溶液进行实验,其余的试剂及操作与实验Ⅰ的均相同。
通过实验Ⅱ和实验Ⅲ,小华得出结论:样品中可能含有的物质确实存在。
(2)实验Ⅱ所得无色滤液中,除酚酞以外,还含有的溶质为_____;
(3)实验Ⅲ中代替氢氧化钙溶液的试剂是________溶液,可观察到的现象为________。
32.(7分)探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。
(1) 该实验的目的是________、________。两支长颈漏斗中产生的现象的不同之处是________。
(2)若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量________(填“多”、“少”或“相等”)。
(可能用到的相对原子质量:H-1O-16Mg-24Cl-35.5Fe-56)
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。
A:称取一定质量的样品 加入足量的稀盐酸 过滤、洗涤、干燥、称量所得固体质量
搅拌
B:称取一定质量的样品 加入足量的硫酸铜溶液 过滤、洗涤、干燥、称量所得固体质量
 搅拌
搅拌
(3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。
(4)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数________(填“偏大”、“偏小”、“不变”或“无法判断”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com